Термический коэффициент полезного действия для кругового процесса
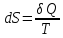
В
результате кругового процесса система
возвращается в исходное состояние,
следовательно, полное изменение
внутренней энергии равно нулю. Поэтому,т.е. работа, совершаемая за цикл, равна
количеству полученной извне теплоты.
Если в ходе кругового процесса система
не только получает количество теплоты,
но и теряет (отдает) количество теплоты,
то.
Термический
коэффициент полезного действия для
кругового процесса – это величина,
равная отношению работы, совершенной
системой, к количеству теплоты, полученному
в этом цикле системой:
.
(40.1)
§ 41. Энтропия
«Энтропия»
в переводе с греческого означает поворот,
превращение. Это понятие введено в
термодинамику немецким ученым Р.
Клаузиусом как мера необратимого
рассеяния энергии.
Количество
теплоты
,
которое должно быть доставлено системе
или отнято у неё при переходе от одного
состояния в другое, не определяется
однозначно начальным и конечным
состояниями, но существенно зависит от
способа осуществления этого перехода
.
Однако,
приведенное количество теплоты –
отношение теплоты
к температуре
Т
системы при бесконечно малых изменениях
состояния системы – есть функция
состояния системы.
В любом
обратимом круговом процессе
.
Следовательно, подынтегральное выражение
есть полный дифференциал некоторой
функции, которая определяется только
начальным и конечным состояниями системы
и не зависит от пути, каким система
пришла в это состояние.
Энтропией
Sназывается
функция состояния системы, дифференциалом
которой является
:
.
(41.1)
Таким
образом, первое начало термодинамики
можно записать в виде
,
откуда
Функция
является функцией состояния системы и
называется энергией Гельмгольца или
свободной энергией.
Изменение
энтропии.
В
замкнутой системе для обратимых процессов
;
для необратимых процессов.
Энтропия
замкнутой системы может либо возрастать
(в случае необратимых процессов) либо
оставаться постоянной (в случае обратимых
процессов):
– неравенство
Клаузиуса.
Поскольку
иимеют один и тот же знак, то по характеру
изменения энтропии можно судить о
направлении процесса теплообмена.
При
нагревании тела
и его энтропия возрастает,
при охлаждениии энтропия убывает.
Принцип
возрастания энтропии:Все
процессы в замкнутой системе ведут к
увеличению её энтропии. В замкнутой
системе идут в направлении от менее
вероятных состояний к более вероятным,
до тех пор, пока вероятность состояния
не станет максимальной. В состоянии
равновесия – наиболее вероятного
состояния системы- число микросостояний
максимально, при этом максимальна и
энтропия.
§ 42. Второе начало термодинамики
Выражая
всеобщий закон сохранения и превращения
энергии, первое начало термодинамики
не позволяет определить направление
протекания процесса. В самом деле,
процесс самопроизвольной передачи
энергии в форме теплоты от холодного
тела к горячему, ни в какой мере не
противоречит первому закону термодинамики.
Однако при опускании раскаленного куска
железа в холодную воду никогда не
наблюдается явление дальнейшего
нагревания железа за счет соответствующего
охлаждения воды. Далее, первое начало
не исключает возможности такого процесса,
единственным результатом которого было
бы превращение теплоты, полученной от
нагревателя в эквивалентную ей работу.
Так, например, основываясь на первом
начале можно было бы попытаться построить
периодически действующий двигатель,
совершающий работу за счет одного
источника тепла (например, за счет
внутренней энергии океана). Такой
двигатель называется вечным двигателем
второго рода. Обобщение огромного
экспериментального материала привело
к выводу о невозможности построения
вечного двигателя второго рода. Этот
вывод получил название второго начала
термодинамики.
Существует
ряд различных по форме, одинаковых по
существу формулировок второго начала:
Невозможен
процесс, единственным результатом
которого является превращение всей
теплоты, полученной от нагревателя, в
эквивалентную ей работу.Формулировка
Клаузиуса: теплота сама собой не может
переходить от менее нагретого тела к
более нагретому.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Из первого закона термодинамики для кругового процесса следует:
= dU + , но т.к. в круговом процессе изменение внутренней энергии dU= 0, то = т.е. работа за цикл совершается получаемой извне теплоты: = , где – количество теплоты, полученной системой; – количество теплоты, отданное системой.
Термический КПД: = = = 1 .
Тепловые двигатели
Теплово́й дви́гатель — устройство, совершающее работу за счет использования внутренней энергии, тепловая машина, превращающая тепло в механическую энергию, использует зависимость теплового расширения вещества от температуры. (Возможно использование изменения не только объёма, но и формы рабочего тела, как это делается в твёрдотельных двигателях, где в качестве рабочего тела используется вещество в твёрдой фазе.) Действие теплового двигателя подчиняется законам термодинамики. Для работы необходимо создать разность давлений по обе стороны поршня двигателя или лопастей турбины. Для работы двигателя обязательно наличие топлива. Это возможно при нагревании рабочего тела (газа), который совершает работу за счёт изменения своей внутренней энергии. Повышение и понижение температуры осуществляется, соответственно, нагревателем и охладителем.
Тепловой двигатель – периодически действующий двигатель, совершающий работу за счёт полученной извне теплоты.
В тепловом двигателе используется прямой цикл.
Термостат – термодинамическая система, которая может обмениваться теплотой с телами без изменения собственной температуры.
Рабочее тело – термодинамическая система, совершающая круговой процесс и обменивающаяся энергией с другими телами. В тепловом двигателе рабочим телом обычно является газ.
Рассмотрим действие теплового двигателя (тепловой машины).
Под поршнем цилиндра (рис. 127) находится газ. Диаграмма состояния рабочего тела изображена в координатах (P,V) (рис. 128).
Рис. 127.
Приведём дно цилиндра в тепловой контакт с нагревателем, т.е. с телом, температура которого выше температуры газа в цилиндре. Газ будет нагреваться и расширяться по пути 1а2. Рабочее тело получит от нагревателя количество теплоты и совершит положительную работу А1.
Рис. 128.
По первому закону термодинамики: = (U2 – U1) + А1.
Теперь надо вернуть поршень в исходное положение, т.е. сжать газ. Это надо сделать так, чтобы работа А2, затраченная на сжатие, была меньше работы А1: А2 < А1. С этой целью приведём дно цилиндра в тепловой контакт с холодильником, т.е. телом, температура которого ниже температуры газа в цилиндре, и сожмём газ по пути 2б1. В результате рабочее тело вернётся в состояние 1 и отдаст холодильнику количество теплоты . По первому закону термодинамики: = (U2 – U1) – А2.
В итоге получаем: = А1 – А2 = А.
Таким образом, тепловая машина совершила круговой процесс, в результате которого нагреватель отдал тепло , а холодильник получил тепло ; тепло = пошло на производство работы А.
Вывод: для того, чтобы машина работала повторными циклами, часть полученной от нагревателя теплоты должна быть отдана холодильнику.
Схематическое устройство теплового двигателя
Схематическое устройство теплового двигателя изображено на рис. 129.
Рис. 129.
Принцип работы теплового двигателя
От термостата с температурой Т1 (нагреватель) за цикл отнимается количество теплоты , а термостату с температурой Т2 (холодильник; Т2 < Т1) за цикл передаётся количество теплоты , при этом совершается работа : А = .
Очевидно, чем полнее превращает тепловая машина полученную ею теплоту в работу, тем машина выгоднее. Эффективность тепловой машины характеризуется коэффициентом полезного действия (КПД):
= = = 1 1.
Из определения КПД следует, что он не может быть больше единицы.
Источник
Круговым процессом, или циклом, называется такой процесс, когда система, пройдя через ряд промежуточных состояний, возвращается в исходное состояние. Графически круговой процесс изображен на рис. 6.8 замкнутой кривой и состоит из участка расширения (1а2) и сжатия (2b1).
Рис.6.8
Для расширения газу от тела с температурой Т1, называемого нагревателем, сообщается количество теплоты Q1. В процессе сжатия газ отдает количество теплоты Q2 телу с температурой Т2 < Т1, называемому холодильником.
Если цикл идет по часовой стрелке, то он называется прямым. Положительная работа расширения А, совершаемая газом и численно равная площади фигуры (V1 1a2V2), больше отрицательной работы сжатия А2, совершаемой над газом и выражаемой площадью фигуры (V2 2b1V1). Следовательно, работа А, совершенная за цикл и численно равная площади фигуры(1а2b1), будет положительна:
А = А1 – А2 > 0
Прямой цикл используется в тепловых машинах – периодически действующих устройствах, превращающих тепло, полученное от нагревателя, в работу А.
Так как в результате кругового процесса система возвращается в исходное состояние, то изменение внутренней энергии, как функции состояния, ΔU = 0.
Следовательно, согласно первого закона термодинамики (6.21) для кругового процесса
Q = A
Учитывая, что Q = Q1 – Q2, имеем:
А = Q1 – Q2
Определим термический коэффициент полезного действия цикла, как отношение работы А к полученной системой теплоте:
(6.46)
Может ли КПД теплового двигателя быть равен 100 %?
Это будет (согласно 6.46) только, если Q2 = 0. Как показал С. Карно, такое невозможно: для работы теплового двигателя необходимо часть тепла, полученного от нагревателя, отдать холодильнику. Это утверждение о невозможности создания теплового двигателя, работающего с одним только источником теплоты (вечный двигатель второго рода) составляет содержание второго закона термодинамики: невозможен вечный двигатель второго рода, т.е. процесс, единственным результатом которого было бы превращение теплоты, полученной от нагревателя, в работу.
Цикл (рис.6.8) может идти и против часовой стрелки. Тогда его работа будет отрицательна. Такой цикл называется обратным и используется вхолодильных машинах для переноса (за счет работы внешних сил) теплоты от тела с более высокой температурой к телу с температурой более низкой. Процесс перехода системы из состояния 1 в состояние 2 называется обратимым, если после возвращения системы в исходное состояние ни в системе, ни в окружающей среде никаких изменений не происходит. Любой процесс, не удовлетворяющий этим условиям, называется необратимым.
Все реальные процессы необратимы. Примером необратимости является процесс теплообмена, при котором теплота самопроизвольно переходит от горячего тела к холодному, однако обратного самопроизвольного процесса произойти не может.
Таким образом, обратимые процессы – понятие идеализированное. Однако их изучение важно, поскольку многие реальные процессы в природе и технике близки к обратимым, и именно они являются наиболее экономичными.
Цикл Карно
Основываясь на втором законе термодинамики, С. Карно доказал, что из всех тепловых машин наибольшим КПД обладают обратимые машины. Самым экономичным является круговой процесс, состоящий из двух изотерм и двух адиабат (рис.6.9), названный циклом Карно.
Можно показать, что КПД цикла Карно определяется только температурами нагревателя Т1 и холодильника Т2:
(6.47)
Рис.6.9
Как следует из (6.47), для повышения η необходимо увеличивать разность температур Т1 нагревателя и Т2 холодильника.
Энтропия
Из формул (6.46) и (6.47) следует, что и
Учтем, что количество тепла Q2, отданного холодильнику отрицательно. Тогда последнее равенство можно записать:
(6.48)
Отношение Q/T называется приведенной теплотой.
Приведенная теплота, переданная системе нагревателем, при бесконечно малом ее изменении, равна δQ/Т. Можно показать, что для любого обратимого кругового процесса сумма приведенных теплот равна нулю. Тогда выражение (6.48) в общем, виде может быть записано как:
(6.49)
Равенство нулю интеграла по замкнутому контуру означает, что в обратимом процессе подинтегральное выражение есть полный дифференциал некоторой функции S, зависящей только от состояния системы. Функция S называется энтропией.
Таким образом
(6.50)
Из формулы (6.49) следует, что для обратимых процессов изменение энтропии
ΔS = 0 (6.51)
Можно показать, что для необратимых неравновесных процессов, происходящих в замкнутой системе, энтропия возрастает
ΔS > 0 (6.52)
Соотношения (6.51) и (6.52) объединяются в неравенство Клаузиса:
ΔS≥0
т.е. энтропия замкнутой системы либо возрастает, либо остается постоянной.
Так как реальные процессы необратимы, то можно утверждать, что все процессы, протекающие в замкнутой системе, ведут к увеличению энтропии. Это утверждение, называемое принципом возрастания энтропии, является еще одной формулировкой второго закона термодинамики.
Физический смысл энтропии выяснил Л. Больцман, который показал, что энтропия связана с термодинамической вероятностью состояния системы. Термодинамическая вероятность w определяется как число способов, которыми может быть реализовано данное состояние системы. Согласно Больцману, связь S и w выражается формулой:
S = k lnw (6.53)
где k – постоянная Больцмана.
Когда достигается равновесное состояние системы, то в этом состоянии система может оставаться сколь угодно долго, т.е. параметры системы не меняются и в системе отсутствуют потоки энергии или вещества. Если потоки имеют место, то изменение внутренней энергии dU может происходить не только за счет сообщения системе теплоты δQ и совершения над ней работы δА, но и за счет переноса массы. Тогда первый закон термодинамики можно записать в более общей форме
dU = δQ – PdV + μdn,
где называется химическим потенциалом и представляет изменение энергии системы, приходящейся на одну частицу, участвующей в переносе при V = const и S = const.
Фазовые превращения
Фазой называется термодинамически равновесное состояние вещества, отличаются не химическим составом, а физическим свойствами от других равновесных состояний того же вещества (например, вода может находиться в трех фазах: жидком, твердом и в виде пара). Переход вещества из одной фазы в другую называется фазовым переходом.
Различают фазовые переходы I и II рода. Фазовый переход I рода связан с поглощением или выделением тепла (например, плавление и кристаллизация). Фазовый переход II рода не связаны с теплотой (например, переход некоторых веществ при определенных температурах в сверхпроводящее состояние см. п.5.7).
Для характеристики фазовых переходов используются диаграммы состояний (обычно в координатах Р – Т). На этих диаграммах можно найти точку одновременного равновесного осуществления трех фаз – тройную точку. Например, тройная точка для воды 273,16 К. Термодинамика позволяет рассчитать равновесие двух фаз одного вещества, пользуясь уравнением Клапейрона – Клаузиуса:
,
где производная от равновесного давления по температуре зависит от теплоты фазового перехода λ, температуры перехода и изменения объема фаз (например, при замерзании воды ее объем возрастает).
Источник
В процессе расширения газ производит работу против сил внешнего давления. Для того чтобы вновь повторить тот же процесс расширения газа и вновь получить работу , нужно возвратить газ в исходное состояние т.е. сжать газ. При этом газ совершит круговой процесс (цикл). На сжатие газа, естественно, должна быть затрачена работа; эта работа подводится к газу от какого-либо внешнего источника.
Понятно, что процесс сжатия газа от давления p2 до давления p1 нужно осуществить по пути, отличному от пути процесса расширения. В противном случае работа, получаемая при расширении газа, будет равна работе, затрачиваемой на сжатие, и суммарная работа, полученная в результате кругового процесса, будет равна нулю. Работа, отдаваемая системой за один цикл (будем называть ее работой цикла), равна разности (алгебраической сумме) работы расширения и работы сжатия. Понятно, что путь процесса сжатия следует выбрать таким образом, чтобы работа сжатия по абсолютной величине была меньше работы расширения, иначе работа цикла будет отрицательной, т.е. в результате цикла работа будет не производиться, а затрачиваться; впрочем, как будет показано в дальнейшем, в определенных случаях (циклы холодильных машин) используется именно такое построение цикла.
Циклические процессы, в результате которых производится работа, осуществляются в различных тепловых двигателях. Тепловым двигателем называют непрерывно действующую систему, осуществляющую круговые процессы (циклы), в которых теплота превращается в работу. Вещество, за счет изменения состояния которого получают работу в цикле, именуется рабочим телом.
Типовой процесс в pV координатах.
Работа цикла находит очень удобную графическую интерпретацию в p, V-диаграмме.
Если 1-а-2 — кривая процесса расширения, а 2-b-1 — кривая процесса сжатия, то площадь под кривой 1-а-2 равна работе расширения, площадь под кривой 2-b-1 — работе сжатия, а площадь, ограниченная замкнутой кривой (кривой цикла) 1-a-2-b-1, представляет собой работу цикла.
Работа цикла Lц равна количеству теплоты, подведенной извне к рабочему телу. В соответствии с первым законом термодинамики: работа, производимая двигателем, строго равна количеству теплоты, отобранной от внешнего источника и подведенной к рабочему телу двигателя. Если бы можно было построить такой тепловой двигатель, в котором количество производимой работы было больше, чем количество теплоты, подведенной к рабочему телу от внешнего источника, то это означало бы, что первый закон термодинамики (закон сохранения и превращения энергии) несправедлив. Из этого следовало бы, что можно построить такой тепловой двигатель, в котором работа производилась бы вообще без подвода теплоты извне, т.е. вечный двигатель.
Что касается теплоты Qц, которая превращается в работу, то следует отметить, что на одних участках цикла теплота к рабочему телу подводится, на других — отводится. Как будет показано далее, отвод определенного количества теплоты от рабочего тела на некоторых участках цикла является неотъемлемым условием осуществимости цикла любого теплового двигателя.
Если обозначить теплоту, подводимую к рабочему телу в цикле, через Q1, а теплоту, отводимую от рабочего тела в цикле, через Q2, то очевидно, что
И тогда в соответствии с первым законом термодинамики:
Введем новое понятие о так называемом термическом коэффициенте полезного действия (КПД) цикла. Термическим КПД цикла называют отношение работы цикла к количеству теплоты, подведенной к рабочему телу в цикле. Обозначая термический КПД цикла ηт, получаем в соответствии с этим определением:
Термический КПД цикла характеризует степень совершенства того или иного цикла: чем больше ηт, тем совершеннее цикл; при подводе к рабочему телу одного и того же количества теплоты Q1 в цикле, у которого ηт больше, производится большая ′ работа Lц.
Введем понятие об источниках теплоты. Систему, от которой отбирается теплота Q1, сообщаемая рабочему телу цикла, принято называть горячим источником теплоты , а систему, которой отдается теплота Q2, отбираемая от рабочего тела, холодным источником теплоты.
Спасибо за прочтение материала. В следующий раз материал про будет про обратимые и необратимые циклы, которые приведут нас к формулировке второго закона термодинамики.
Источник
