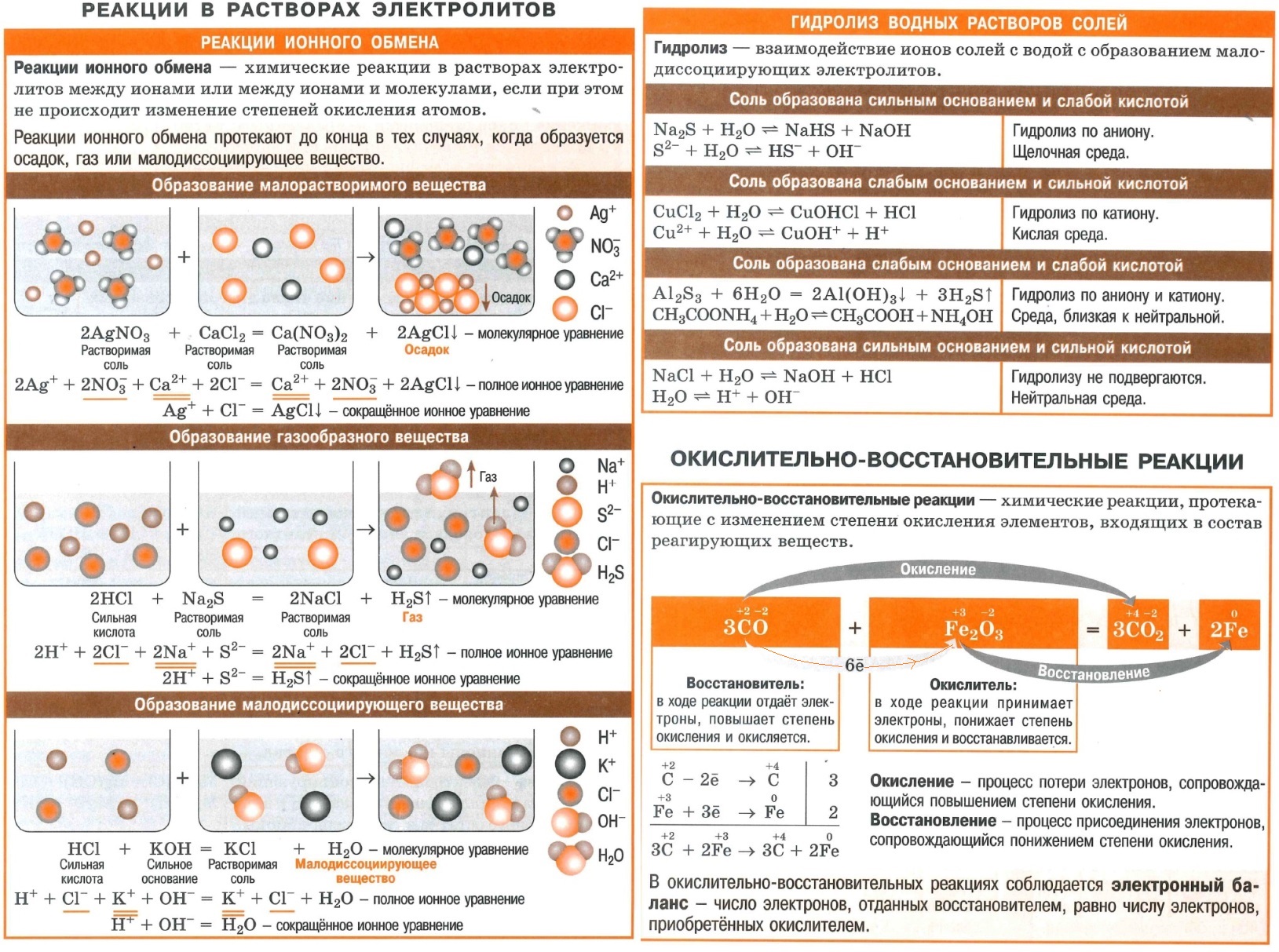
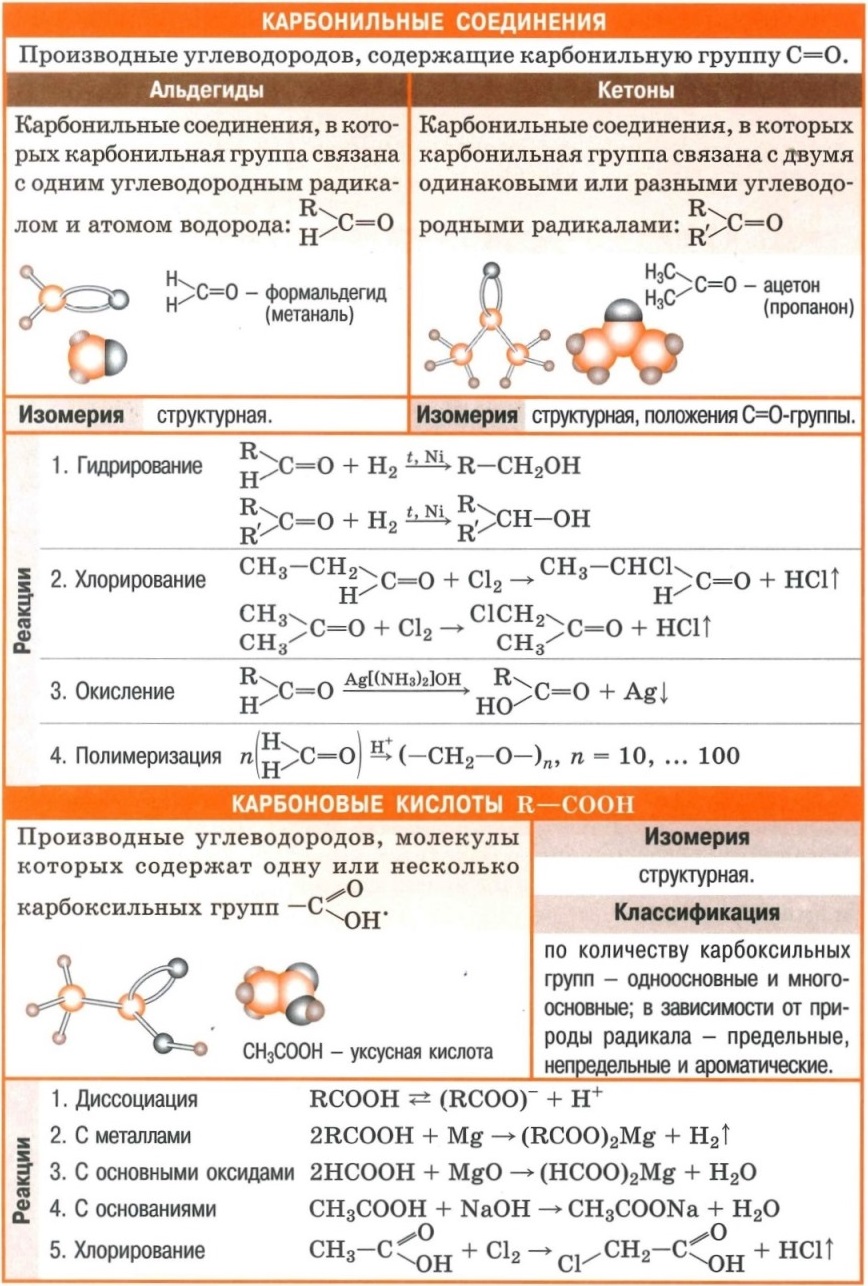
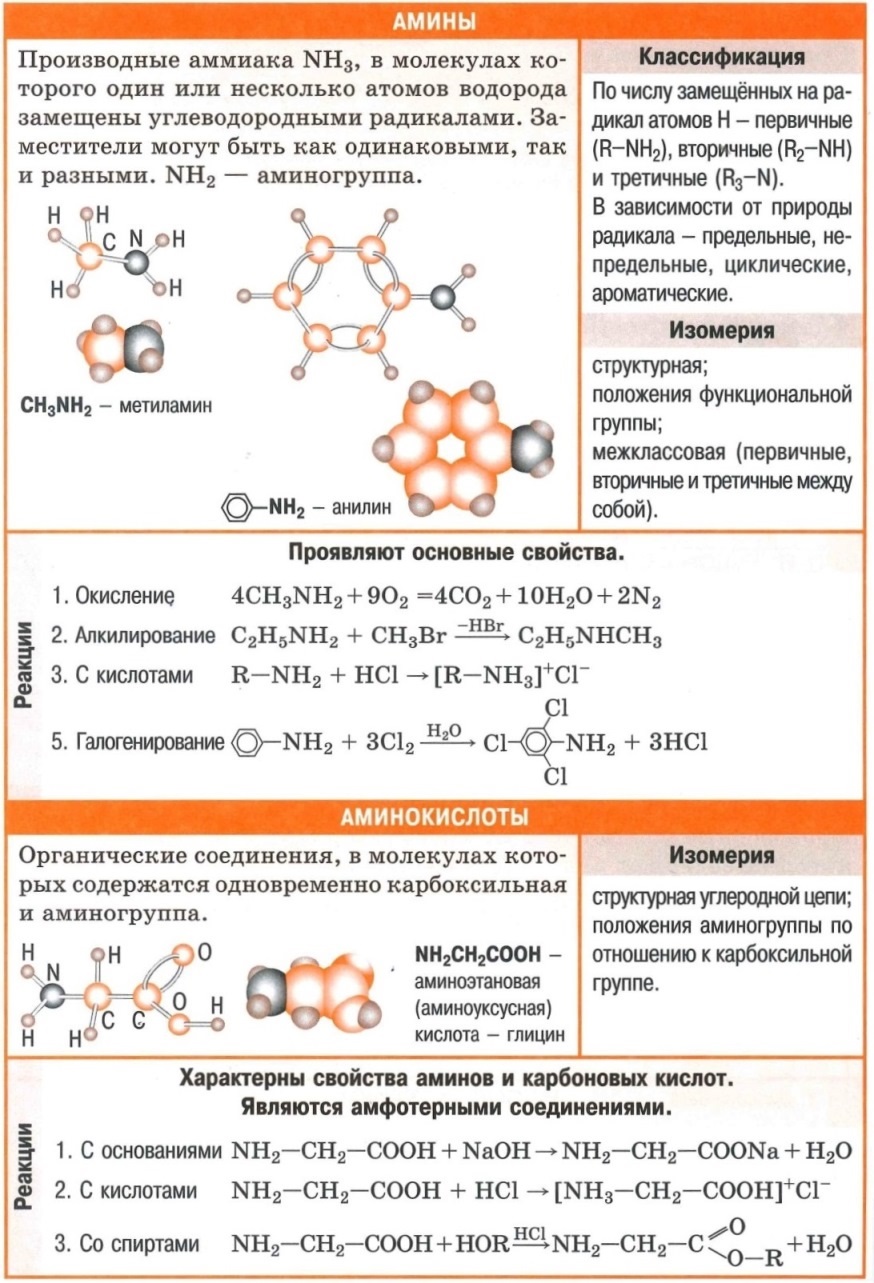
Полезные шпаргалки на егэ по химии

Сдать ЕГЭ по химии на сто баллов — это просто мечта, не находите? А ведь мечта вполне реальная! Для этого требуется только две вещи: узнать все об этом экзамене и подготовиться к нему. Хотите узнать, что вам предстоит пройти на пути к заветным баллам?
Структура ЕГЭ по химии
На выполнение экзамена будет ровно три с половиной часа, и за это время нужно успеть набрать 60 первичных баллов, чтобы получить максимум за экзамен. Звучит страшно, но давайте разбираться.
Вам предстоит решить 35 заданий:
Тестовые номера (ответ — цифры):
- №1-4, 19-24 — общая химия,
- №5-10, 25 — неорганическая химия,
- №11-18, 25 — органическая химия,
- №27-29 — математика,
- №26 — практика из «жизни».
Задания с развернутым ответом:
- №30 — ОВР,
- №31 — РИО,
- №32 — неорганическая цепочка,
- №33 — органическая цепочка,
- №34 — неорганическая задача,
- №35 — органическая задача.
Причем, не решив последние две задачи, нельзя даже рассчитывать на 90+ баллов!
Но паниковать рано. Вас не оставят со сложными химическими приспособлениями один на один: на химии вас ждет целых три легальных шпаргалки! В КИМ ЕГЭ по химии включены самые необходимые формулы (а часть нужной информации можно найти в заданиях), а также на экзамене вам выдадут таблицы Менделеева и растворимости. Этого более чем достаточно для написания ЕГЭ на высокий балл.
Также позволительно проносить с собой на экзамен непрограммируемый калькулятор, в том числе и инженерный.
Темы экзамена
ЕГЭ по химии проверяет знание четырех основных разделов химии (это около сорока тем):
- Общая химия — от вас требуется знать основы строения атома и вещества, а также основные способы взаимодействия веществ.
- Неорганическая химия — в этом разделе проверяется знание и понимание принципа работы химических свойств основных классов неорганических веществ и важных групп элементов.
- Органическая химия — а вот этот раздел целиком и полность построен на углеводородах и их важных производных, так что от вас потребуется изучить их химические свойства просто досконально.
- Математика — так условно можно назвать раздел, включающий в себя задания на математические расчеты в уравнениях химических реакций.
Пройти темы «Реакции ионного обмена», «Задание 35», «Химическая реакция» и «Расчетные задачи» можно на бесплатных курсах с домашними заданиями, рассказывали о них в статье: Подборка 39 бесплатных онлайн-курсов ЕГЭ и ОГЭ (нашли все предметы!)
Полезные материалы для подготовки
Про бесплатные курсы уже сказали выше, а также хотим поделиться:
- Список всех тем ЕГЭ по химии, разделенных по направлениям. Список в виде чек-листа, чтобы можно было отслеживать свой прогресс.
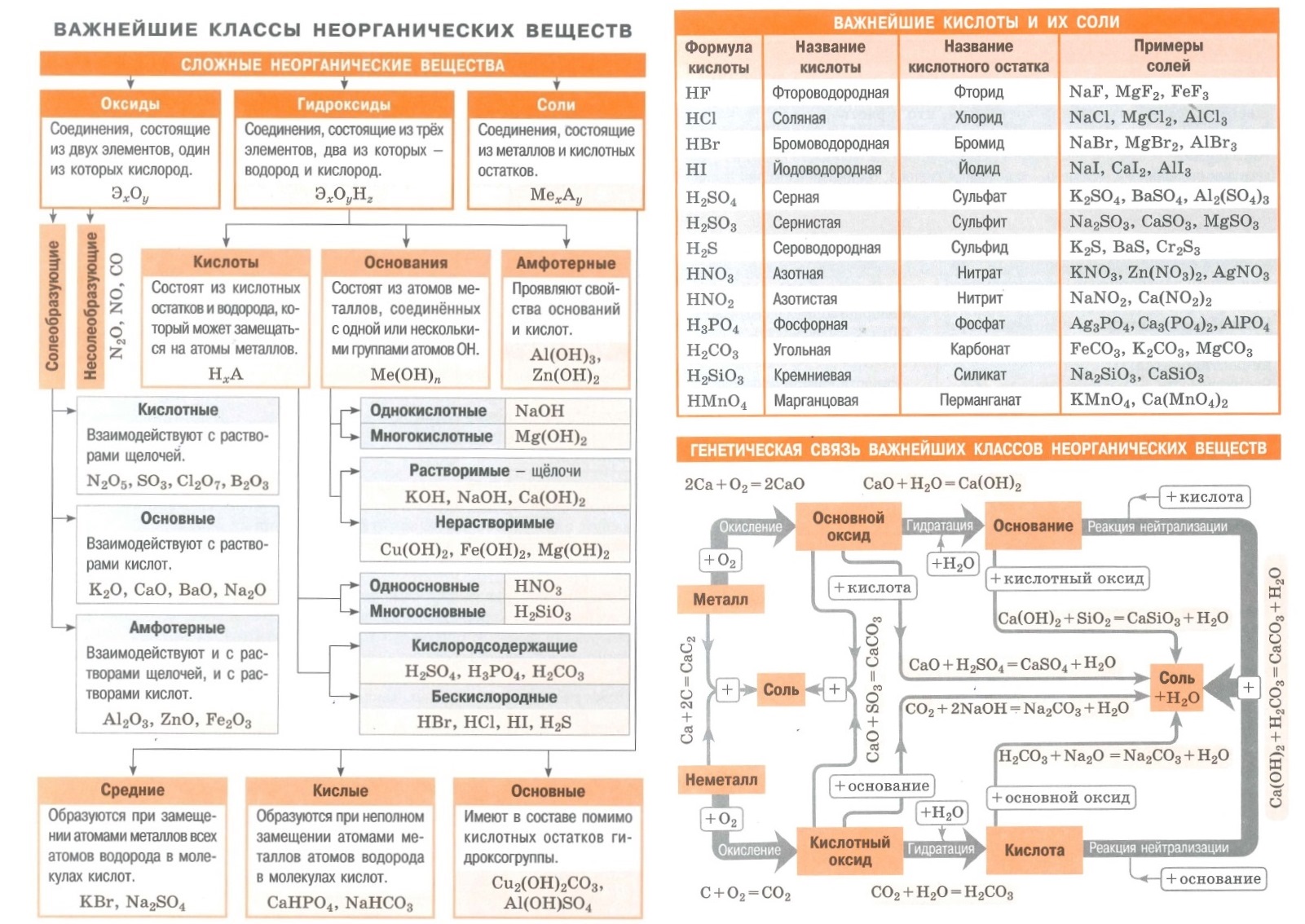
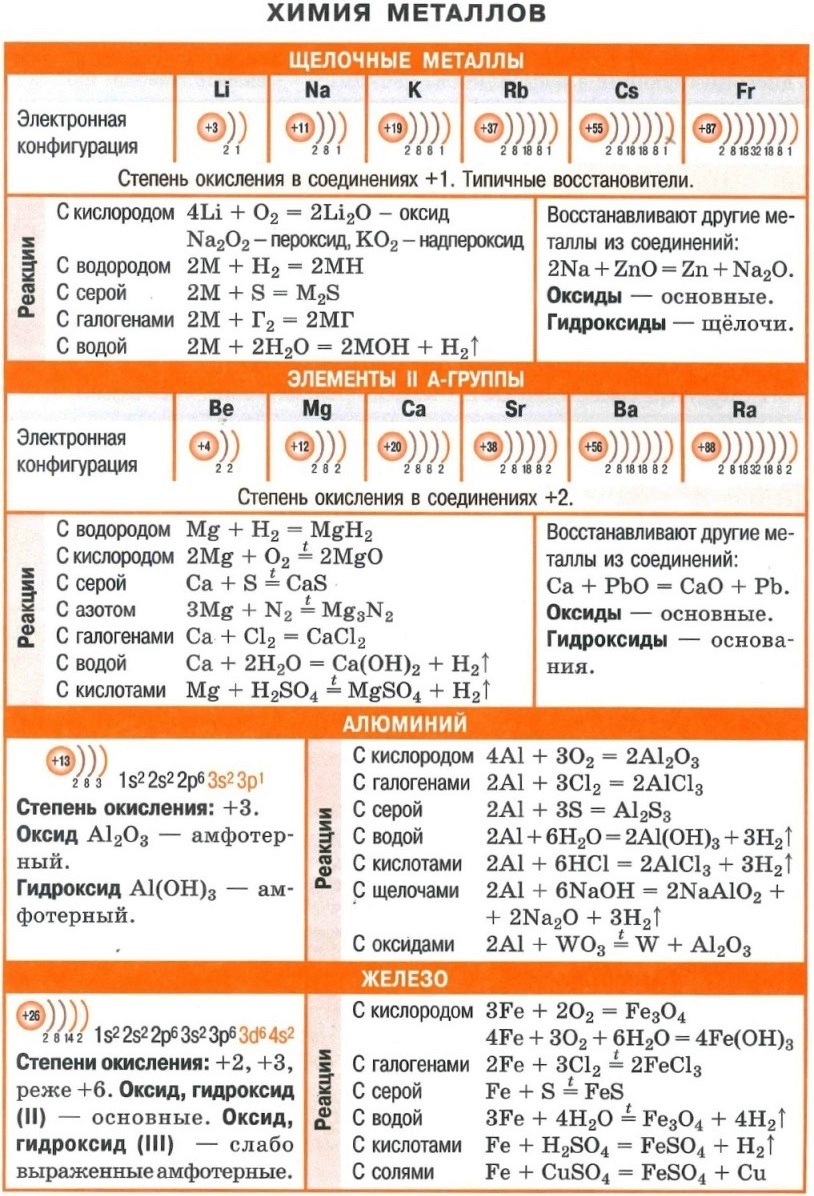
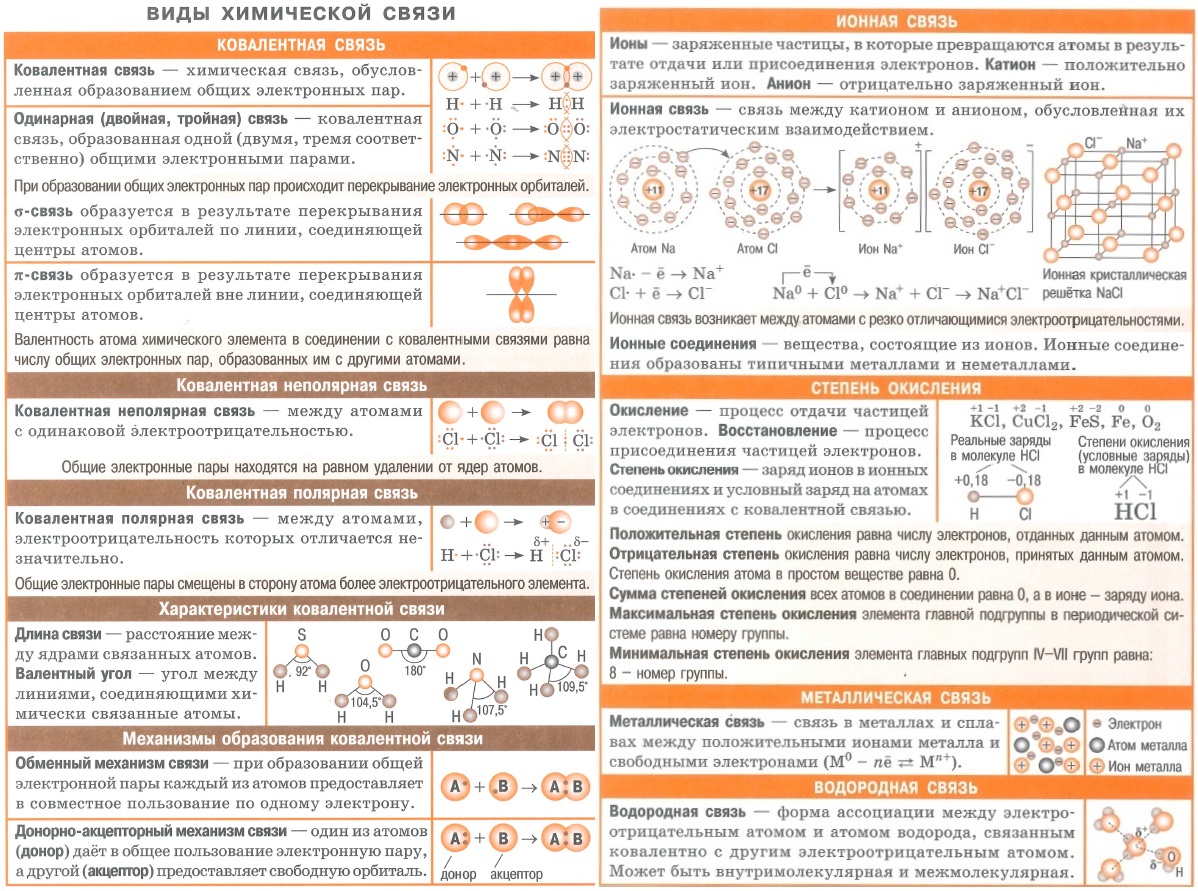
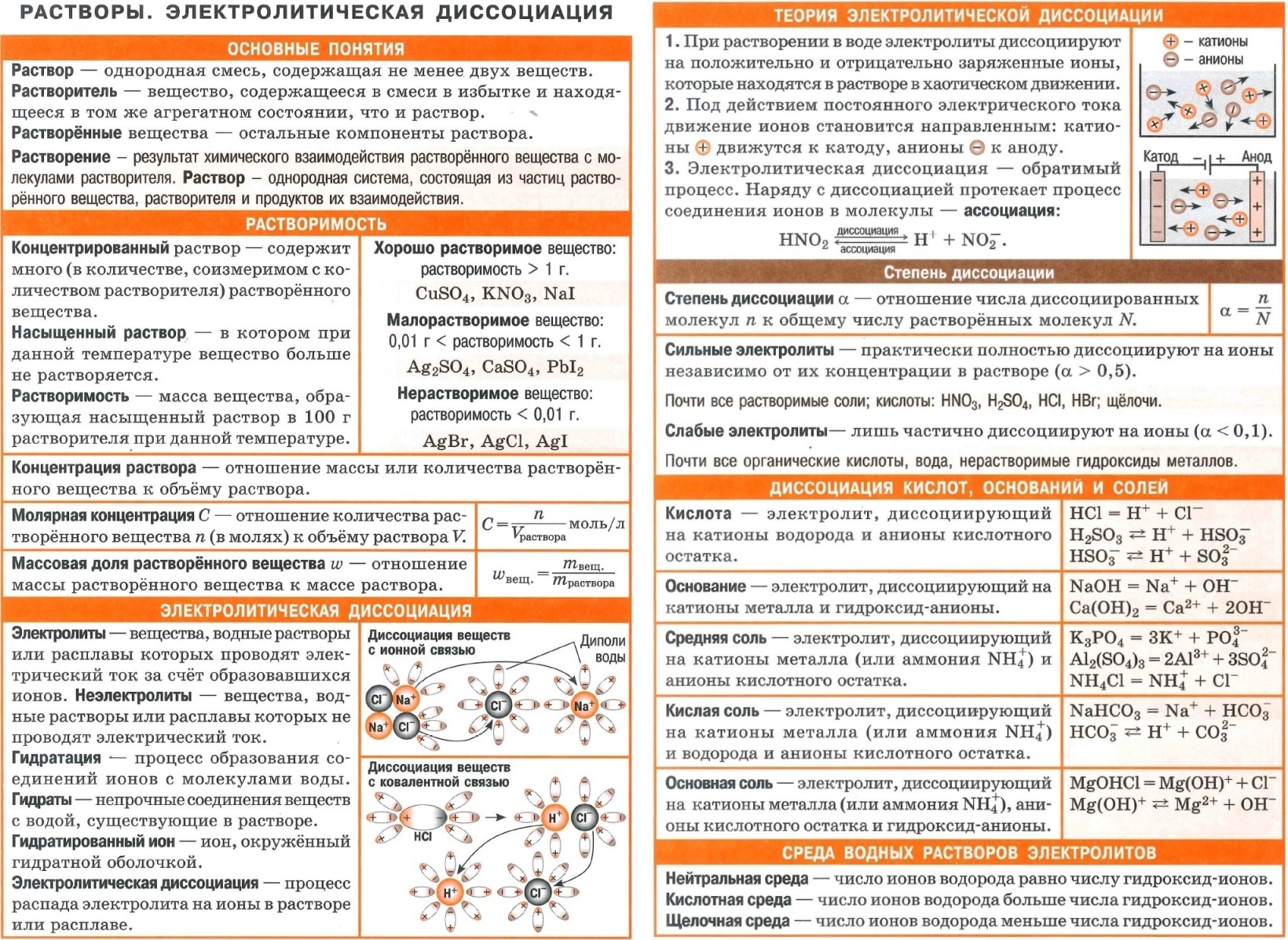
- Вся неорганика в одном файле
- Чек-лист по решению ОВР
- Вся органика в схемах
На самом деле, чтобы получить заветные сто баллов, нужно знать совсем немного: темы, которые предстоит изучить, и время, которое у вас есть. А дальше — целиком и полностью вопрос подготовки.
И раз все необходимое вы уже знаете, пора приступать к практике?
Чтобы получать бесплатные уроки по химии и другие авторские материалы для подготовки от онлайн-школы Умскул, подпишитесь на еженедельную базу знаний ВКонтакте.
Больше статей на про подготовку к ЕГЭ по химии по хэштегам: #ум_егэ_химия #ум_егэ
Готовьтесь к ЕГЭ, пока все отдыхают.
А мы делимся знаниями, которые сами по себе позволяют подготовиться на хорошие баллы и компенсируют репетиторов. В 2020 году ученики онлайн-школы Умскул набрали на 27,5 баллов больше, чем усредненный балл по России. Проводим бесплатные вебинары каждую неделю. Чтобы получить доступ к материалам, подпишитесь на бесплатную рассылку ОГЭ или ЕГЭ. Присоединяйтесь к нашему блогу и готовьтесь с лучшими!
В этом вам помогут статьи:
Источник
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Ой, как это мы позабыли о 9-х классах! Завтра уже ОГЭ по химии, а мы все ЕГЭ никак не выкашляем. Вот так всегда – ставка на сильного, впередиидущего, а все остальные просто подтягиваются.
Не торопитесь соглашаться и поддакивать. Задайтесь вопросом, как нужно изучать химию? Ежегодными кусками с повышением уровня сложности? Ребята дорогие, при таком подходе (методике) вы даже не поймете, какой предмет изучаете! Есть определенная структура (система) предмета. Ее и нужно изучать!
Я работаю репетитором более 30 лет и никогда не делила учеников на классы. Мы просто поднимаемся по ступеням системы химии или биологии. Скорость подъема (изучения предмета) определяется временем, которое имеется до защиты знаний (экзамена) – год, два или три (я не работаю с более ранним возрастом). В минигруппах учатся ребята из разных классов. Девятые и десятые классы тянутся за одиннадцатыми. Часто бывает наоборот, когда рулят девятые классы. Тогда у одиннадцатиклассников формируется стойкая мотивация на учебу – стыдно быть лузером среди мелких. Совместное участие в процессе изучения предмета и обмена опытом объединяет ребят (я бы даже сказала, духовно роднит), они начинают общаться и после занятий. Дружба продолжается во время учебы в ВУЗе, где более старшие опекают тех, кто поступил позже. Это замечательно! Ребенок, взрослея, не только изучает биологию и химию, адаптируясь к учебе в высшей школ, но и проходит стадию социализации среди более опытных сотоварищей.
Однако, я отвлеклась. Сегодня, за сутки до ОГЭ по химии, я хочу подарить своим ученикам и всем моим любимым читателям замечательную шпаргалку, которую легко можно пронести на экзамен!
– Как так?! – возмутятся в Рособрнадзоре!
– А вот так! – отвечу я.
Во-первых, это не обычная шпаргалка, а логическая схема, которая очень легко запоминается. Во-вторых, такую схему легко пронести в голове (здесь, уж точно, никакой детектор не обнаружит и камеры не просекут).
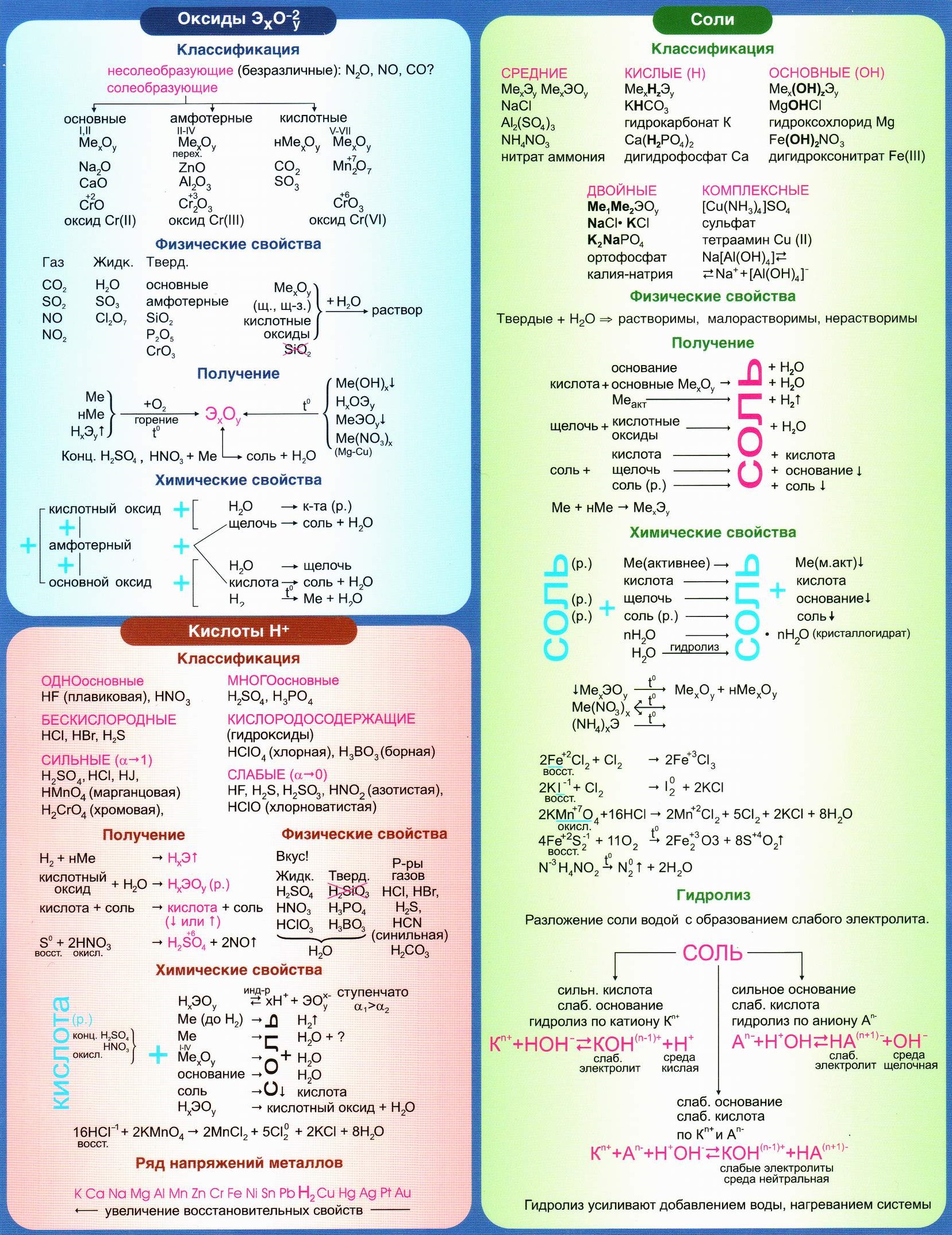
В качестве подарка хочу предложить схему изменения свойств элементов (и, соответственно, веществ) по Периодической Системе.
Основные понятия
1) Неметаллы (Н на схеме) – на внешнем (валентном) электронном уровне имеют 4-7 электронов, легко принимают электроны
С неметаллическими свойствами связаны кислотные свойства оксидов и кислородсодержащих кислот: чем активней неметалл, тем сильнее кислота (при одинаковой степени окисления элемента)
2) Металлы (М на схеме) – на внешнем (валентном) электронном уровне имеют 1-3 электрона, легко отдают электроны
С металлическими свойствами связаны основные свойства оксидов и гидроксидов: чем активней металл, тем сильнее основание.
3) Электроотрицательность (ЭО на схеме) – способность атома притягивать к себе электроны (и свои, и чужие).
Электроотрицательность тесно коррелирует (соотносится) с неметаллическими свойствами и окислительной активностью. Это хорошо видно на схеме.
4) Радиус атома (РА на схеме) – расстояние между атомным ядром и самой дальней орбитой электронов в электронной оболочке атома.
Радиус атома тесно коррелирует (соотносится) с металлическими свойствами и восстановительной активностью. Это видно на схеме.
С радиусом атома связаны кислотные свойства бескислородных кислот: чем больше радиус атома, тем сильнее бескислородная кислота (HF<HCl<HBr<HI)
5) Энергия ионизации (ЭИ на схеме) – количество энергии, которое атом должен поглотить для освобождения электрона; образуется ион-катион (+ заряжен положительно).
Энергия ионизации коррелирует с электроотрицательностью: чем больше электроотрицательность, тем больше энергия ионизации.
Энергия ионизации и радиус атома связаны обратной зависимостью: чем больше радиус атома, тем меньше энергия ионизации.
6) Сродство к электрону (СЭ на схеме) – энергия, которая выделяется или поглощается в процессе присоединения электрона к свободному атому; образуется ион-анион (- заряжен отрицательно).
Сродство к электрону численно равно, но противоположно по знаку энергии ионизации: чем выше энергия ионизации, тем ниже энергия сродства к электрону (и наоборот).
7) Окислительная активность (О на схеме) – способность отбирать электроны у других атомов.
Окислительная активность коррелирует с неметаллическими свойствами и электроотрицательностью. Это видно на схеме.
8) Восстановительная активность (В на схеме) – способность отдавать валентные электроны (электроны внешнего уровня) другим атомам.
Восстановительная активность коррелирует с металлическими свойствами и радиусом атома. Это хорошо видно на схеме.
Схема изменения свойств по ПСЭ
NB! Схема касается только элементов главных подгрупп!!!
Для желторотиков – смотрим только элементы, расположенные в розовых и желтых клеточках
Все, о чем было сказано в сегодняшней статье, относится к важнейшим понятиям химии. В ОГЭ это представлено в заданиях 2 и 16.
Вы хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками, многие из которых уже давно закончили ВУЗы и, работая врачами, спасают наши с вами жизни.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции (бесплатно). Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Репетитор по химии и биологии кбн В.Богунова
Источник
Проект Карла III Ребане и хорошей компании |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Техническая информация тут Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Шпаргалки по химии. Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Уже который день моя статья “Тайны задач по химии? 1. Препарируем задачу ЕГЭ” вызывает нервные тики у вполне спокойных и уверенных в себе учителей. Не так они представляют себе решение задач. Им нужно, чтобы все было запутано и мало понятно, а на вопрос ученика: “Как решить задачу?” учитель, сделав умные глаза, отвечал бы: “Думай”. А чем думать? Как думать? Куда думать? В какую сторону? Сие есть тайна великая! Однако, все тайное становится явным на вскрытии задач ЕГЭ. Вот и моя статья показала, какие приколы (фишки) для ЕГЭ по химии могут приготовить нашим детям сотрудники ФИПИ.
35-е задание ЕГЭ по химии (Задачи на нахождение формулы вещества) – одно из самых интересных заданий ЕГЭ. От этих задач веет немножко Копперфильдом: делаешь расчеты – проводишь анализ химических свойств – составляешь структурную формулу вещества. Но не все так однозначно и просто. Как показал анализ “вскрытия” одной из 35-х задач, ученик может столкнуться с очень накрученным (т.е. комбинированным) заданием, в которое авторы на основе нахождения формулы вещества умудрились втиснуть множество элементов из разных разделов алгоритмики и теоретической химии. Чтобы достойно справиться с решением 35-й задачи, а также других заданий ЕГЭ, нужно в процессе подготовки тщательно отрабатывать (шлифовать) каждый отдельно взятый алгоритмический элемент (алгоритмическую фишку): вначале – на простых заданиях, а затем – на комбинированных. Чем я и занимаюсь с учениками и планирую рассказывать об этом в своих статьях.
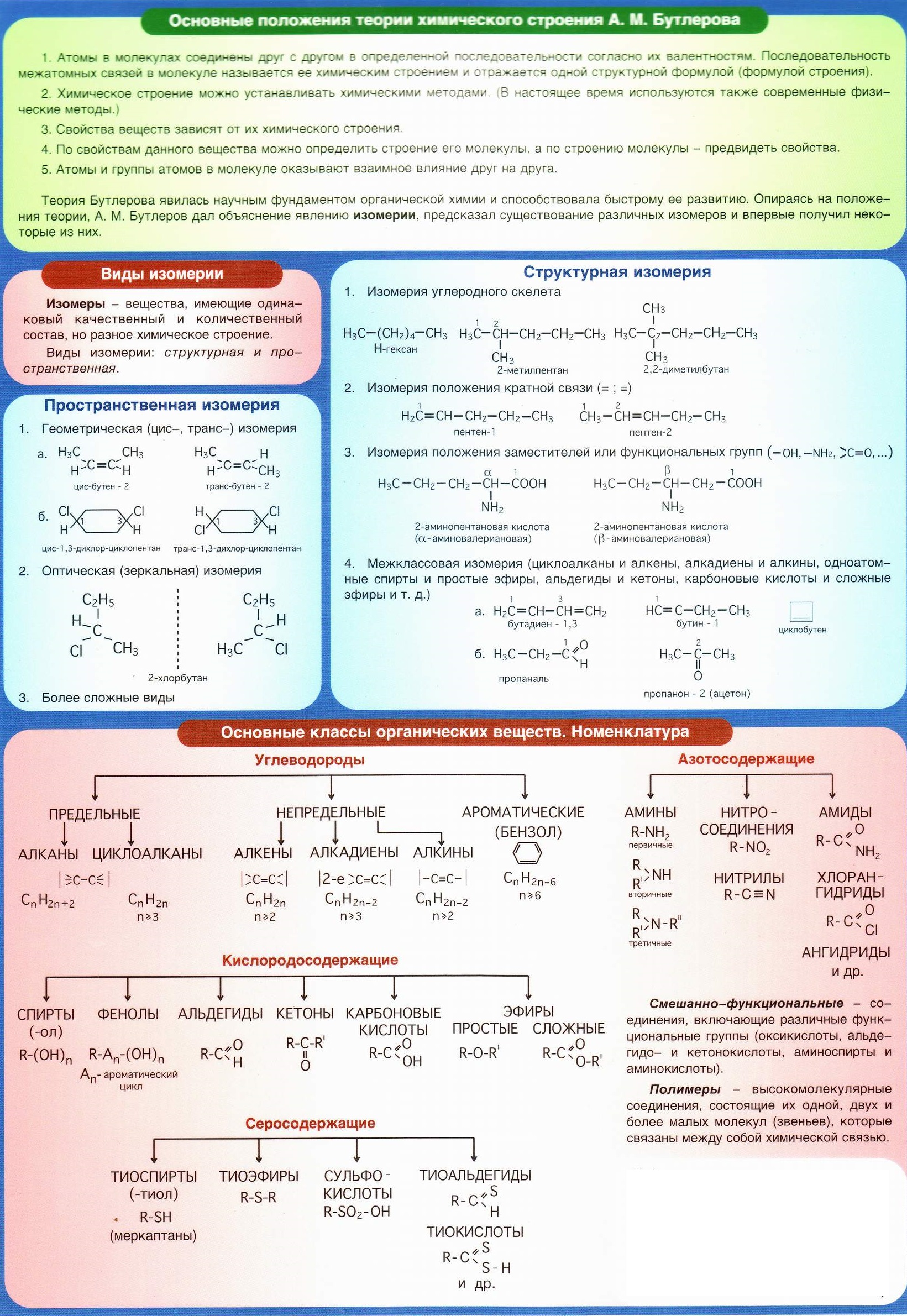
Авторская Система Задач по Химиинасчитывает несколько типов алгоритмов на вывод формулы вещества: по массовой доле, по продуктам сгорания, по стехиометрическим коэффициентам, по формуле в общем виде. Постепенно я буду рассказывать очень подробно о каждом алгоритме. Сегодня я хочу проработать специфику алгоритма Вывод формулы вещества по общей формуле класса. Итак, поехали!
Вывод формулы вещества по общей формуле класса
Алгоритм решения строится на логической схеме М(реал) = М(общ)
М(реал) – реальная молярная масса, которая рассчитывается по многим формулам. На фото я представляют основные формулы расчета реальной молярной массы
М(общ) – молярная масса вещества в общем виде, рассчитывается по общей формуле класса веществ. На фото можно увидеть примеры расчета молярной массы вещества в общем виде
В основе алгоритма задачи лежит составление уравнение с одним неизвестным, решение которого приводит к ответу. Потренируемся решать несложные задачи по этому алгоритму
Задача 1
Углеводород имеет формулу CnH2n-2. Определите n, если известно, что 0,8 моль углеводорода имеют массу 43,2 г.
Задача 2
Органическое вещество имеет формулу CnH2n+2О. Определите n, если известно, что 0,7 моль углеводорода имеют массу 32,2 г.
Задача 3
Масса одной молекулы ромбической серы равна 4,252•10-22 г. Рассчитайте число атомов в одной молекуле ромбической серы
Задача 4
Алкен массой 28 г содержит 3,01∙1023 молекул. Определите структурную формулу алкена, если известно, что при его окислении подкисленным раствором перманганата калия образуется ацетон.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии https://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Источник
Скоро все будет в одном месте)
Лови чек-лист продуктивности
Как им пользоваться:
Распечатай чек-лист и повесь его над своим столом/вклей в тетрадь для подготовки к химии
Уверенно закрашивай те дни, и те недели, в которые ты учил(а) химию
Визуально наблюдай за своим прогрессом и хвали себя
И обязательно придумай себе доп-мотивации!
ПРИМЕР ИСПОЛЬЗОВАНИЯ ЧЕК-ЛИСТА:
ШАГ 1: поставь себе цели. Цель может быть и в одну строчку: “Буду заниматься химией 3 раза в неделю”, а может быть и длиннее (по хештегу #мастер_менделеевой можешь почитать какую декларацию заполняют наши ученики)
ШАГ 2: обязательно придумай себе вознаграждение! Пообещал(а) заниматься химией 3 раза в неделю? Обещание выполнено? Тогда смело закрась зеленым цветом неделю в чек-листе (2ая страница) и порадуй себя шоколадкой/часом игры на компьютере/прогулкой с друзьями/походом в кино. Бонус ты выбираешь сам(а) для себя!
НАБЛЮДАЙ ВИЗУАЛЬНО ЗА СВОИМ ПРОГРЕССОМ И НЕ УПУСКАЙ ВРЕМЯ ВПУСТУЮ
МЕТОДИЧКА ПО РЕШЕНИЮ 27-28-29 ЗАДАНИЙ ЕГЭ
Эта методичка объяснит тебе простым языком как решать 27-29 задачи
В нашем проекте их справедливо называют кладбищем баллов, потому что множество ребят на экзамене допускают там ошибки
Самое крутое, что химии в этих задачах на самом деле меньше чем математики!
Покажем тебе как использовать в основном математику и базовое понимание химических величин
В этом документе мы постарались весело и понятно объяснить самые простые способы решения таких задачек
+ чек-лист для подготовки к ЕГЭ на год вперед
СОХРАНЯЕШЬ – РАСПЕЧАТЫВАЕШЬ – УЧИШЬ МАТЕРИАЛ В ПРАВИЛЬНОМ ПОРЯДКЕ – СДАЕШЬ НА 90+
Разобрали задания первой части ЕГЭ по химии.
__________________________________
Преподаватель-супергерой: Елена Капитан
– окончила киевский национальный университет
– педагогический стаж с 2003
– репетиторская деятельность с 2008
+ любима всеми нашими мастерами – вам она тоже понравится!
Разобрали типы связей и кристаллические решетки
ВЫХОД РЕАКЦИИ: решение задач
Тема: ВСЕ О МЕТАЛЛУРГИИ
Что разобрали:
Понятие металлургии
Общие способы получения металлов
Практика по 26 заданию ЕГЭ
Тема: Классификация органических веществ
На этом вебинаре тебя ждет:
– Общие формулы каждого класса органических веществ (понадобится при решении 35 задачи)
– Практика по 11 заданию ЕГЭ
КАЧЕСТВЕННЫЕ РЕАКЦИИ В НЕОРГАНИЧЕСКОЙ ХИМИИ
Что тебя ждет?
– качественный анализ на экзамене
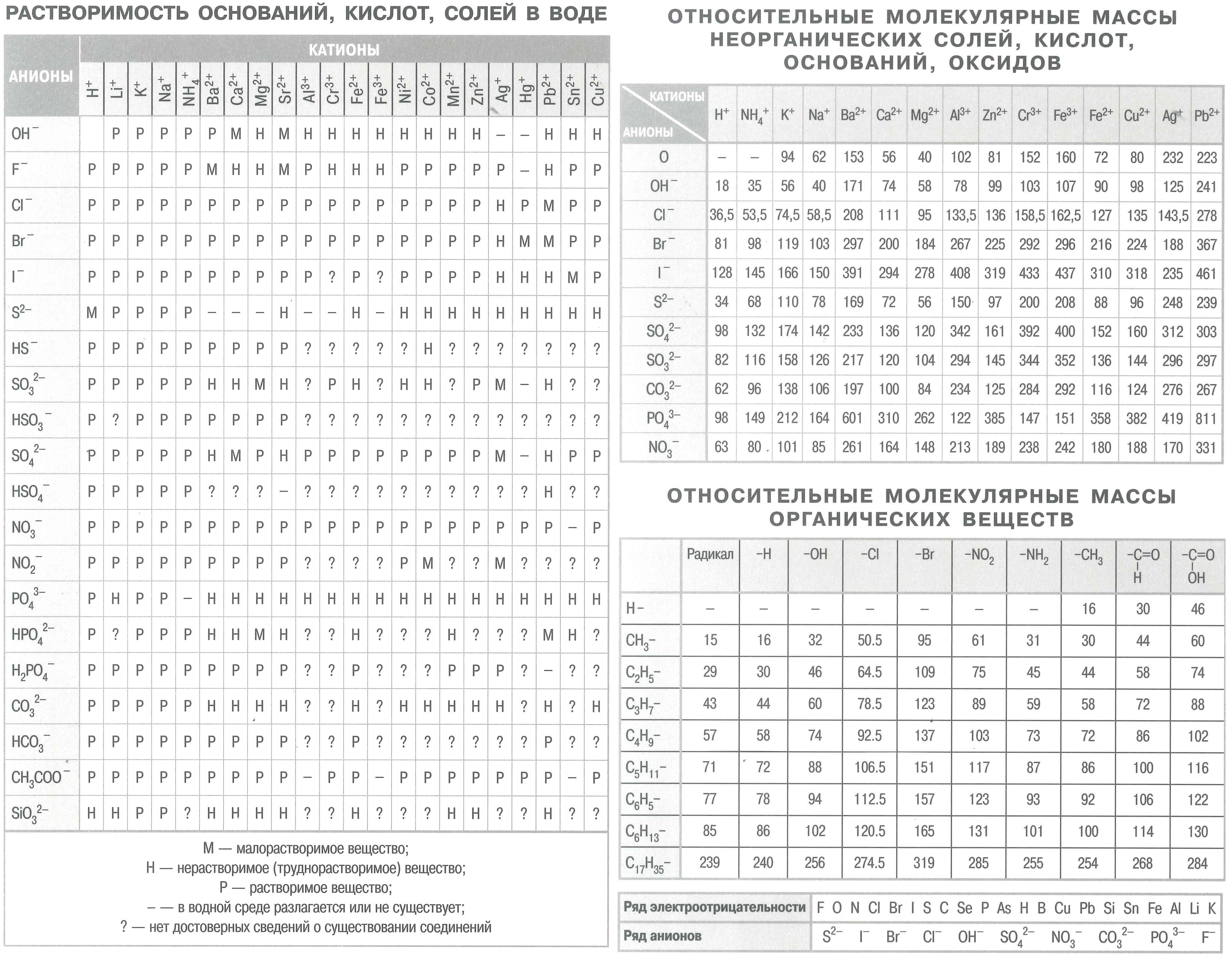
– таблица растворимости – твоя шпаргалка?
– практика по 25 заданию
8 И 9 ЗАДАНИЕ: сложности и лайфхаки
Что тебя ждет на вебе:
Лайфхаки, которые помогут упростить решения этих заданий
+ будет много практики! Да да, будем повторять неорганику
Краткий обзор хим. свойств простых веществ
На этом вебинаре ты узнаешь:
– химические свойства всех простых веществ
– все исключения и особенности
– практику по неорганичсекой химии
Тема: ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Что разбираем:
Химическое равновесие, факторы и примеры решения заданий ЕГЭ
Тема: 34 ЗАДАЧА: основные типы
Что разберем:
Каждое действие и принцип решения
Практика по заданиям из прошлых лет
Тема: КАК ПОДГОТОВИТЬСЯ К ЕГЭ ЗА 4 МЕСЯЦА?
Тема: 10 лайфхаков для подготовки к ЕГЭ по химии на 80+ баллов
Источник