Как найти полезную работу в термодинамике
ВНУТРЕННЯЯ ЭНЕРГИЯ
Под внутренней энергией термодинамической системы понимают кинетическую энергию теплового движения ее молекул и потенциальную энергию их взаимодействия. Она зависит от параметров состояния V,T . Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуре:
Для газов, состоящих из более сложных молекул, также U ~ Т , но коэффициент пропорциональности другой. Это объясняется тем, что такие молекулы не только движутся поступательно, но и вращаются.
РАБОТА В ТЕРМОДИНАМИКЕ
Если газ расширяется при постоянном давлении р, то сила, действующая со стороны газа на поршень: F = рS, гдеS – площадь поршня.
При подъеме поршня на высоту газ совершает работу
где ΔV – изменение объема газа.
При медленном сжимании газа работа, совершаемая внешними телами над газом, будет отличаться только знаком:
Работа, совершаемая термодинамической системой при постоянном давлении, равна
КОЛИЧЕСТВО ТЕПЛОТЫ
Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом.
Количество теплоты – это энергия, переданная телу в результате теплообмена.
Теплоемкость С – количество теплоты, необходимое для нагревания тела массой m на 1 К. Удельная теплоемкость с – это количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К: c=C/m
Для изменения температуры вещества массой m от Т1 до Т2 ему необходимо сообщить количество теплоты
Коэффициент с в этой формуле называют удельной теплоемкостью: [с]=1 Дж/(кг*К).
При нагревании тела Q > 0, при охлаждении Q < 0.
Для того, чтобы жидкость массы m полностью превратить в пар, ей необходимо передать количество теплоты
Q=rm
где r – удельная теплота парообразования: [r] = 1 Дж/кг .
Удельная теплота парообразования – это количество теплоты, которое необходимо для превращения 1 кг жидкости в пар при постоянной температуре.
Конденсация – процесс, обратный испарению.
Для того, чтобы расплавить полностью тело массой m , ему необходимо сообщить количество теплоты
Q= λm
где – удельная теплота плавления: {λ} = 1 Дж/кг .
Удельная теплота плавления – это количество теплоты, которое необходимо для плавления 1 кг кристаллического вещества при температуре плавления.
Кристаллизация – процесс, обратный плавлению.
Для замкнутой системы, состоящей из N тел, можно записать уравнение теплового баланса:
Q1+…+Qn=0
где Q1, … , QN – количества теплоты, полученные или отданные телами.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Закон сохранения энергии
Энергия не возникает из ничего и не исчезает, она только переходит из одной формы в другую. Закон сохранения энергии, распространенный на тепловые явления, называется первым законом термодинамики.
Первый закон термодинамики
Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
Этот закон можно сформулировать иначе:
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
В первой формулировке А – работа, совершаемая над системой (над газом), во второй А’ – это работа, совершаемая системой (газом).
Вечный двигатель первого рода – устройство, способное совершать неограниченное количество работы без подведения энергии извне.
Из первого закона термодинамики следует невозможность создания вечного двигателя первого рода. Если к системе не поступает теплота, то
Иными словами, работа совершается системой за счет уменьшения ее внутренней энергии. После того, как запас энергии будет исчерпан, двигатель перестанет работать.
Процесс, протекающий в теплоизолированной системе, называют адиабатным.
Абсолютно исключить теплопередачу невозможно, но иногда реальные процессы близки к адиабатным. Они протекают за очень малый промежуток времени, в течение которого не происходит существенного теплообмена между системой и внешними телами.
ТЕПЛОВЫЕ ДВИГАТЕЛИ
Тепловые двигатели – устройства, превращающие внутреннюю энергию топлива в механическую энергию.
Любой тепловой двигатель состоит из трех основных частей.
Рабочее тело – газ, совершающий работу А’ при расширении.
Нагреватель – устройство, от которого рабочее тело получает количество теплоты Q 1
Холодильник – устройство, которому рабочее тело передает количество теплоты Q2
Коэффициентом полезного действия (КПД) теплового двигателя называют отношение работы,совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
Так как Q2 < Q1, то всегда < 1.
Идеальная тепловая машина Карно – модель теплового двигателя, в котором рабочим телом
является идеальный газ. КПД машины Карно
где Т1 – температура нагревателя, T2 – температура холодильника.
Реальная тепловая машина не может иметь КПД, превышающий КПД идеальной тепловой машины.
Пример. Объем кислорода массой 160 г, температура которого 27°С, при изобарном нагревании увеличился вдвое. Найдите работу газа при расширении, количество теплоты, которое пошло на нагревание кислорода, изменение внутренней энергии.
Величина работы, совершаемой газом при изобарном процессе, когда V = V2 – V1 = V1, определяется выражением
С учетом уравнения состояния
можно записать
Изменение внутренней энергии двухатомного газа, с учетом уравнения состояния, будет выглядеть:
Учитывая, что А| = pV1, получим:
Количество теплоты, переданное газу, согласно первому закону термодинамики, идет на изменение его внутренней энергии и совершение газом работы:
Ответ: работа газа равна 12,5 кДж, количество теплоты, которое пошло на его нагревание, равно 43,8 кДж, изменение внутренней энергии – 31,3 кДж .
Источник
В этой статье рубрики «физика для чайников» рассмотрим подробное решение нескольких задач на работу в термодинамике. Тем, кто хочет научиться решать задачи, рекомендуем систематически тренироваться, предварительно ознакомившись с теорией. А еще, полезно почитать памятку по решению физических задач и держать под рукой основные физические формулы.
Чтобы не заскучать, подписывайтесь на наш телеграм-канал. Там вас ждет ежедневная рассылка, которая будет полезна всем учащимся.
Примеры решения задач на работу в термодинамике
Задача №1. Работа расширения
Условие
При адиабатическом расширении 1 кг воздуха его объем увеличился в 10 раз. Найти работу расширения, если начальное давление 1 атм, а начальная температура 15 °С.
Решение
Зная молярную массу воздуха (29 г/моль), начальный объем можно найти из уравнения Клапейрона-Менделеева:

Не забываем переводить все физические величины из условия в систему СИ.
Из условия находим конечный объем:
Работа равна:
Ответ: 751 кДж.
Задача №2. Работа в цикле Карно
Условие
Температура нагревателя идеальной тепловой машины составляет 227 °С, а охладителя — 27 °С. За один рабочий цикл тепловая машина получает количество теплоты, равное 100Дж. Какую работу совершает рабочее тело идеальной тепловой машины за один цикл?
Решение
Из формулы для КПД можно выразить искомую работу:
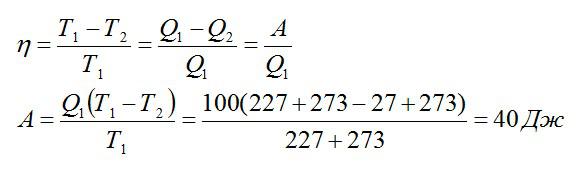
Ответ: 40 Дж.
Задача №3. Работа при выдувании мыльного пузыря
Условие
Определить работу, которую необходимо совершить, чтобы выдуть мыльный пузырь диаметром 10 см.
Решение
Работа, которую нужно совершить, чтобы, выдувая мыльный пузырь, увеличить площадь поверхности мыльной пленки на дельта S, равна:
Здесь сигма – коэффициент поверхностного натяжения для мыльного раствора (берется из таблицы). S – общая площадь двух сферических поверхностей пленки мыльного пузыря (внешней и внутренней). S нулевое – площадь этих поверхностей до выдувания пузыря (этой величиной можно пренебречь).
Ответ: 2,5 мДж.
Задача №4. Графическое представление работы
Условие
Газ расширяется от объёма V1 до объёма V2 один раз изотермически, другой изобарно и третий адиабатно. При каком процессе газ совершает большую работу и при каком газу передаётся большее количество теплоты?

Решение
Работа численно равна площади криволинейной трапеции. Из рисунка очевидно, что работа при изобарном процессе будет максимальной, при адиабатном минимальной, т. е.

Ответ: см. выше.
Задача №5. Работа газа
Условие
Газ совершает круговой процесс, состоящий из нескольких этапов. Сначала газ изохорно охлаждается до температуры, при которой его давление равно P2 = 105 Па. Затем он изобарно охлаждается до состояния, из которого возвращается в начальное состояние таким образом, что его давление изменяется с изменением объема по закону Р = αV (α – постоянная величина). Начальные объем и давление газа известны: V1 = 2 м3, Р1 = 4·105 Па. Нарисовать график данного кругового процесса на РV-диаграмме и найти работу, совершенную газом.
Решение
Сначала выполним рисунок:

Точки состояния газа 1 и 3 лежат на прямой, проходящей через центр координат:
C учетом этого, получаем:
Работа газа в данном случае равна площади треугольника 123:
Подставим найденное ранее значение для V3, преобразуем и подставим значения из условия:
Ответ: 2,25*10^5 Дж.
Вопросы на тему «Работа в термодинамике»
Вопрос 1. Что такое работа в термодинамике?
Ответ. Работа – одна из форм обмена энергией термодинамической системы с окружающими телами. Работа, как и энергия, измеряется в Джоулях.
Вопрос 2. Сформулируйте первое начало термодинамики.
Ответ. Первое начало термодинамики гласит:
Изменение внутренней энергии системы равно сумме совершаемой над системой работы внешних сил и количества теплоты, переданной системе.
У первого начала термодинамики исторически есть несколько формулировок. Одна из них: невозможно построить вечный двигатель первого рода.
Вопрос 3. При каком из изопроцессов работа газа равна нулю?
Ответ. При изохорном процессе объем системы остается неизменным. Следовательно, газ в данном процессе не совершает работу.
Вопрос 4. Как, совершая работу, можно изменить внутреннюю энергию?
Ответ. Если работа совершается над телом (системой), то его внутренняя энергия увеличивается, если же тело само совершает работу, это ведет к уменьшению его внутренней энергии.
Вопрос 5. Как определить работу газа геометрически?
Ответ. Величина работы газа равна площади фигуры под графиком на диаграмме pV
Нужна помощь в решении задач или в выполнении других студенческих заданий? Обращайтесь в профессиональный студенческий сервис.
Источник
Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
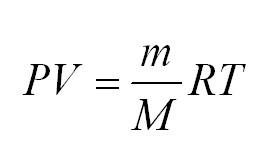
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
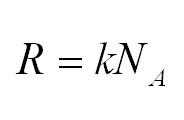
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
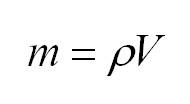
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
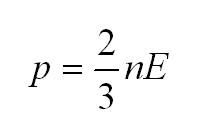
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
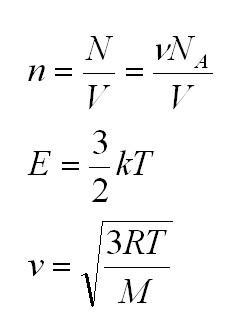
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
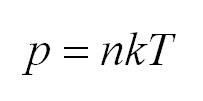
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
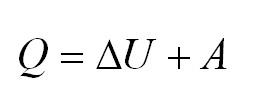
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
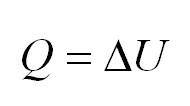
Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
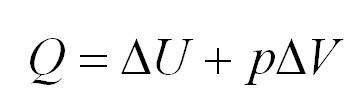
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
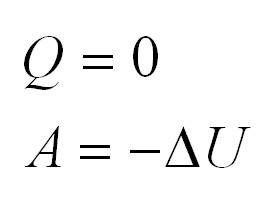
Внутренняя энергия одноатомного и двухатомного идеального газа
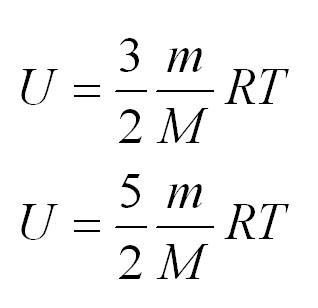
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
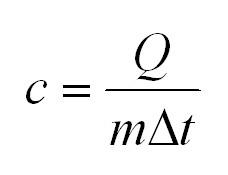
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
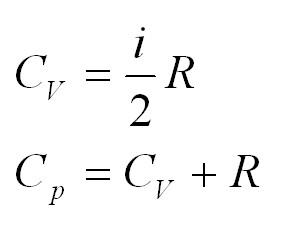
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
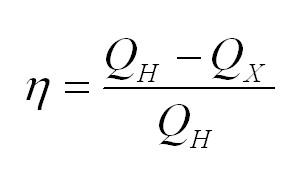
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.
Источник
Запишем I закон термодинамики для неподвижной простой системы
и применим к этому выражению преобразование Лежандра
.
Здесь под знаком полного дифференциала появляется новая функция состояния
, (2.11)
называемая энтальпией(старое название – теплосодержание). Таким образом, первое начало термодинамики может быть записано в двух эквивалентных формах:
(2.12)
Физический смысл энтальпии может быть выяснен после выяснения смысла произведения . Для этого рассмотрим следующий частный пример. Пусть в вертикально расположенном цилиндре под поршнем находится газ (рис.2.1). На поршень давит груз весом G=Mгрg. Если груз вместе с поршнем неподвижны, значит, на поршень снизу действует давление со стороны газа, равное , где f – площадь поршня. Это выражение может быть записано в виде . Умножив левую и правую части этого равенства на высоту h положения поршня от дна цилиндра, получим . Произведение же есть потенциальная энергия груза в поле тяжести Земли, рассчитанная по отношению к положению дна цилиндра. Таким образом, произведение pV представляет собой в рассмотренном частном случае потенциальную энергию поршня вместе с грузом, удерживающего газ в заданном объёме V. Можно показать, что и в общем случае, если система удерживается в объёме V, потенциальная энергия оболочки, удерживающей систему, равняется произведению pV. При этом система не обязательно должна быть заключена в физическую оболочку.
Таким образом, энтальпию следует понимать как энергию расширенной термодинамической системы, включающей в себя саму систему и оболочку, удерживающую систему в заданном объёме.
В результате преобразования Лежандра кроме энтальпии появилось ещё одно слагаемое , имеющее смысл дифференциально малого количества некоторой работы , т.е.
. (2.13)
Интеграл
(2.14)
носит название полезной внешней работы (или располагаемой работы). Выясним смысл полезной внешней работы. Работа , которую можно назвать работой изменения объёма,представляет собой работу, совершаемую системой против внешних сил. Часть этой работы, называемая работой проталкиванияLпр, затрачивается на изменение потенциальной энергии оболочки и может быть вычислена как разность:
. (2.15)
Дифференциал этой работы, очевидно, полный. Далее, вычислим разность . Удобнее проделать это в дифференциальной форме. Имеем
(2.16)
или после интегрирования
, (2.17)
т.е. полезная внешняя работа есть разность между работой термодинамической системы и работой проталкивания.
Графически полезная внешняя работа L’, определяемая интегралом (2.14), изображается площадью слева от кривой зависимости p(V) в координатах p – V (см.рис.2.2).
Таким образом, первое начало термодинамики для простых систем может быть записано в виде
. (2.18)
Запишем также полный дифференциал удельной энтальпии, выбрав в качестве независимых переменных температуру T и давление p системы:
. (2.19)
| Р3.Т6 | Теплоёмкости термодинамической системы | 0.4 часа |
Запишем математическое выражение первого начала термодинамики для простой системы в двух формах (2.12) (с использованием внутренней энергии и энтальпии) в развёрнутом виде с учётом полных дифференциалов для внутренней энергии (2.10) и энтальпии (2.19) и определения количества теплоты (1.31):
(2.20)
Будем поддерживать постоянным объём системы, т.е. положим Такой процесс называется изохорным. Тогда, т.к. теплоёмкость системы зависит от процесса, следует положить . Из первого уравнения (2.20) получаем
, (2.21)
т.е. теплоёмкость при постоянном объёме есть изменение внутренней энергии системы при изменении температуры на единицу при поддержании постоянным её объёма. Таким образом, если имеется независимый способ измерения изменения внутренней энергии тела, то теплоёмкость при постоянном объёме определяется экспериментально. Одним из таких независимых способов является, например, измерение джоулева тепла при протекании постоянного электрического тока через сопротивление.
Аналогичным образом, рассмотрев изобарный процесс, т.е. процесс при постоянном давлении, получим определение теплоёмкости при постоянном давлении:
, (2.22)
т.е. теплоёмкость при постоянном давлении есть изменение энтальпии тела при изменении температуры на единицу при поддержании постоянным давления.
Таким образом, на основании (2.20) теплоёмкость произвольного термодинамического процесса может быть записана в двух эквивалентных формах:
(2.23)
То, что теплоёмкость зависит от процесса, следует из того, что в этих выражениях мы имеем отношения дифференциалов (изменений) двух независимых параметров состояния, которые могут быть произвольными в зависимости от того, как будет организован процесс. В дальнейшем мы рассмотрим частные случаи наиболее употребительных процессов в энергетике.
Обсудим далее первый закон термодинамики в применении к идеальному газу.
| Р3.Т7 | Внутренняя энергия и энтальпия идеального газа | 0.4 часа |
Из молекулярно-кинетического определения идеального газа как совокупности большого числа хаотически движущихся невзаимодействующих материальных точек следует, что единственной формой энергии частиц идеального газа может быть только их кинетическая энергия поступательного движения, вычисленная по отношению к скорости центра масс газа. Тогда под внутренней энергией идеального газа следует понимать суммарную кинетическую энергию поступательного движения частиц, т.е.
, (2.24)
где ; N – число частиц; m – масса одной частицы (все частицы предполагаются одинаковыми).
Дальнейшее развитие теории и сравнение с экспериментальными данными показало, что точечным частицам истинного идеального газа следует тем не менее приписать наличие внутренней структуры. “Точки” в идеальном газе идентифицируются с атомами; если же газ состоит из многоатомных молекул, т.е. из пространственных структур, то при вычислении внутренней энергии такого газа следует учитывать также энергию вращательного движения молекул и энергию колебаний атомов в молекулах. С учётом этого вместо (2.24) следует записать
. (2.25)
Здесь – моменты инерции молекулы относительно её главных осей; – проекции вектора угловой скорости вращения молекулы на её главные оси. Энергией колебаний атомов в молекулах при не очень больших температурах можно пренебречь. Моменты инерции молекулы зависят от её конфигурации, т.е. от положения атомов в молекуле, а также от количества атомов в молекулах. Если молекула одноатомная, то все три её момента инерции равны нулю, если молекула двухатомная (или многоатомная с линейным расположением атомов), то один из её моментов инерции (а именно относительно главной оси, проходящей через атомы) равен нулю, а остальные два отличны от нуля и одинаковы. В общем случае трёх- и более атомной молекулы все три момента инерции отличны от нуля и различны. Таким образом, если пренебречь колебаниями атомов в молекулах, каждая из молекул газа может совершать три движения поступательного характера (движение центра инерции молекулы вдоль трёх осей координат x, y, z) и ноль, два или три вращательных движений (соответственно для одно-, двух- или трёх- и более атомных молекул). Как известно из механики, каждое из возможных движений тела носит название степени свободы. Обозначим число степеней свободы молекулы f. Можно сказать, что каждая из степеней свободы молекулы №k обладает энергией соответственно, причём эта энергия хаотическим образом меняется с течением времени вследствие столкновений молекул. Австрийский физик Людвиг Больцман в конце XIX века методами статистической физики доказал так называемую теорему о равнораспределении энергиипо степеням свободы, согласно которой в среднем при хаотическом движении в равновесии на каждую степень свободы молекулы приходится одинаковая энергия, равная , где постоянная Больцмана. На основании теоремы о равнораспределении выражение для внутренней энергии идеального газа (2.25) можно записать в более простой форме:
. (2.26)
Количество молекул N можно вычислить как произведение числа киломолей ν газа и числа Авогадро NA, в свою очередь число киломолей может быть подсчитано делением массы газа M на молекулярную массу газа μ, определяемую его химической формулой. Таким образом, (2.26) принимает вид
. (2.27)
Используя численные значения числа Авогадро и постоянной Больцмана, находим , т.е. это произведение в точности равно универсальной газовой постоянной. Окончательное выражение для внутренней энергии идеального газа имеет, следовательно, вид
, (2.28)
где учтено определение газовой постоянной (1.45).
Энтальпия идеального газа легко находится из определения (2.11) и термического уравнения состояния (1.46):
. (2.29)
Как и следовало ожидать, внутренняя энергия и энтальпия для идеального газа зависят только от температуры и не зависят ни от объёма, ни от давления, т.е. для идеального газа имеем:
. (2.30)
Это объясняется отсутствием взаимодействия между молекулами идеального газа.
Источник
