Чем оказалась полезной теория химического строения

Основные положения теории химического строения
В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории:
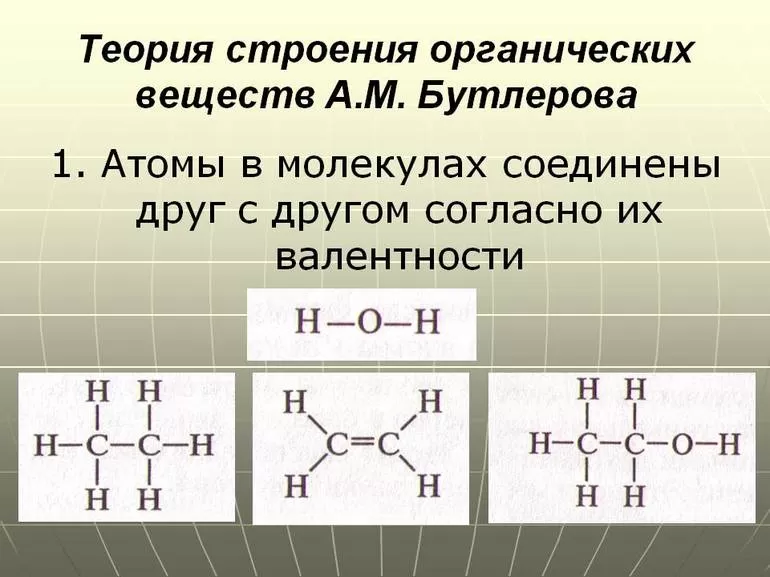
атомы в органических молекулах соединены друг с другом в соответствии с валентностью, при этом углерод всегда четырехвалентен;
порядок соединения атомов в молекуле называется химическим строением;
свойства веществ определяются не только их составом, но и химическим строением;
атомы в молекулах оказывают взаимное влияние друг на друга;
исходя из строения молекулы можно предсказать свойства вещества, и, наоборот, на основании химических свойств можно предсказать строение вещества.
Углеводородные цепи могут быть как открытыми (алициклическими), так и замкнутыми (циклическими), как прямыми, так и разветвленными.
Определение
Гомологи — органические соединения, принадлежащие к одному классу веществ, обладающие сходным строением и свойствами, но отличающиеся друг от друга по составу на одну или несколько групп $СН_2$ и отвечающие одной общей формуле.
Способы отображения строения молекул. Формулы. Модели
Структуру вещества, то есть порядок соединения атомов в молекуле, отображает структурная формула, в которой связи между атомами (или группами атомов) изображаются в виде черточек: одна черточка означает одну связь или одну общую электронную пару. Поскольку углерод в органических соединениях всегда четырехвалентен, то каждый атом углерода может образовывать четыре связи (четыре черточки).
По количеству соседних углеродных атомов, атомы углерода в молекуле подразделяются на первичные (один «сосед»), вторичные (два «соседа»), третичные (три «соседа») и четвертичные (четыре «соседа»). Так, концевые атомы в молекуле углеводородов всегда первичные, в линейных молекулах промежуточные атомы — вторичные, а в разветвленных могут появляться третичные и (или) четвертичные атомы углерода.

Для отображения органических молекул используют молекулярные или брутто-формулы, которые представляют собой сокращенную форму записи количественного и качественного состава.
Например, запись $С_2Н_6$ означает, что молекула вещества состоит из 2 атомов углерода и 6 атомов водорода. Для каждого класса органических соединений можно вывести общую формулу, отвечающую количественному составу всех гомологов. Эту формулу называют общей формулой гомологического ряда. Вещества, принадлежащие к одному классу, отвечают одной общей формуле.
Сравним структурные формулы простейших углеводородов: метана, этана и пропана.

Молекулярная формула метана СН$_4$, этана С$_2$Н$_6$, пропана С$_3$Н$_8$. Видно, что формула этана отличается от формулы метана на одну группу СН$_2$. Аналогично, состав молекул пропана и этана также отличается на одну группу СН$_2$. Следовательно, все эти вещества являются гомологами и относятся к гомологическому ряду метана. Прибавив к формуле пропана указанную гомологическую разницу СН$_2$, получим формулу следующего представителя этого гомологического ряда — С$_4$Н$_{10}$ (бутан):

Для состава С$_4$Н$_{10}$ можно изобразить еще одну структурную формулу:

Следовательно, веществ состава С$_4$Н$_{10}$ должно быть два, каждому из этих веществ соответствует своя структурная формула. Если первое вещество называется бутаном или н-бутаном, то второе — изобутаном. Бутан и изобутан — изомеры, так как у них одинаковый количественный состав, но разный порядок соединения атомов. Подробно с явлением изомерии и изомерами можно познакомиться в теме «Виды изомерии».
Для пространственного отображения структуры молекул органических веществ используют стереохимические формулы.
Стереохимическая формула показывает пространственное расположение атомов в молекулах органических веществ.
Например, пространственное строение этана можно отобразить стереохимической формулой или с помощью проекций Ньюмена, отображающих конформации этана, то есть расположение (поворот) метильных радикалов относительно одинарной С–С-связи:

Более подробно проекции Ньюмена будут рассмотрены в теме «Виды изомерии».
Для наглядности отображения пространственного строения органических молекул используют также разные модели. Наиболее распространенными являются шаростержневые модели, в которых атомы имеют форму шаров, а связи представлены в виде палочек. Одинарная связь — одна палочка, двойная связь — две палочки. Более достоверно истинную структуру молекул отображают масштабные (полусферические) модели:




Значение теории А. М. Бутлерова для развития химии и химического прогнозирования
ТХС органических соединений А. М. Бутлерова внесла существенный вклад в создание общенаучной картины мира, способствовала диалектико-материалистическому пониманию природы. Теория химического строения позволила:
систематизировать органические вещества;
решить спорные вопросы, возникшие к тому времени в органической химии;
прогнозировать существование неизвестных веществ и разработать методики их синтеза.
Современная систематизация огромного разнообразия органических веществ достаточно сложна, например, только класс углеводородов и их производных включает девять основных подклассов:
I. Углеводороды (R–H).
II. Галогенопроизводные (R–Hlg).
III. Спирты ($R–(OH)_n$).
IV. Эфиры простые и сложные (R–O–R’, R–C(O)OR’).
V. Карбонильные соединения (альдегиды и кетоны) (R–C(O)H; R–C(O)–R’).
VI. Карбоновые кислоты (R–COOH).
VII. Амины ($R–NH_2$, R–NH–R’, R–N(R’)–R”).
VIII. Нитросоединения ($R–NO_2$).
IX. Сульфокислоты ($R–SO_3H$).
К классу углеводородов можно также отнести ароматические углеводороды и циклоалканы. Число известных классов органических соединений не ограничивается перечисленными, оно велико и с развитием науки все время увеличивается. Вопросы классификации подробно рассматриваются в теме «Классификация органических соединений».
Все классы органических соединений взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет цепочек химических превращений без изменения углеродного скелета. Органический синтез является основным инструментом при получении новых биологически активных соединений (лекарственных препаратов, косметических средств), красителей, люминофоров и т. д.
Источник
Процесс формирования и развития теории
Первые химические опыты Бутлеров проводил во время обучения в пансионе. Он изготавливал бенгальские огни и порох. Во время преподавания в Казанском и Московском университетах Александр Михайлович написал 2 диссертации: «Об окислении органических соединений» и «Об эфирных маслах». В середине 1850-х гг. он участвовал в заседаниях Парижского химического общества и первым синтезировал сахаристое вещество — метиленитана. Это событие стало предпосылкой создания теории Бутлерова.

Во середине XIX столетия Бутлеров занимался изучением явлений валентности и изомерии. В этот исторический период концепции химического строения сложных веществ основывались на исследованиях химика Йенса Берцелиуса. Ученый предполагал, что все химические соединения являются производными воды, аммиака, водорода и иных неорганических веществ. Учение Берцелиуса легло в основу теории радикалов. Александр Михайлович был несогласен с автором этой концепции и считал, что все формулы должны показывать строение химического вещества.
В феврале 1858 г. Бутлеров презентовал результаты своих исследований на заседании Парижского химического общества. Во время выступления он кратко озвучил главные положения будущей теории химического строения. Предметом исследования являлось строение органических веществ. Александр Михайлович ввел понятие структуры соединений и предложил классификацию сложных веществ, исходя из их химического строения. Он заявил, что для объяснения разных свойств химических соединений важно выделить особенности их главных элементов — атомов.
Вскоре стало понятно, что бутлеровская теория является временной. Она не могла полностью объяснить характеристики и реакционные способности молекул химических веществ. Существует 2 основных направления развития теории Бутлерова:
- Стереохимия. Она исследует пространственное строение молекул химических соединений.
- Дисциплины, посвященные электронному строению атомов. Они описывают причины проявления разных химических свойств.
Теория Бутлерова стала основой для современных исследований сущности взаимного влияния атомов. Она активно применяется не только в химии, но и в физических дисциплинах (при изучении электронного строения мельчайших частиц). Учения Александра Михайловича использовались при создании первой модели атома физиком Джозефом Томсоном.
Главные тезисы теории
Основные положения теории Бутлерова:
- органические вещества имеют одинаковый качественный и количественный состав, вне зависимости от способа их образования;
- валентность углерода, входящего в состав органических веществ, равняется 4;
- существует несколько вариантов соединения атомов в молекуле сложных химических элементов;
- атомы соединены друг с другом в строгой последовательности;
- узнать свойство органического соединения можно при помощи его строения (это правило работает и в обратном направлении);
- атомы, образующие молекулу вещества, взаимно влияют друг на друга (интенсивность влияния зависит от порядка и прочности соединения).
На основе этих тезисов было открыто явление изомерии. Вещества, имеющие идентичный состав и разное химическое строение, были названы изомерами. Примеры изомеров: бутан и изобутан. Они имеют идентичный атомный состав и одинаковую молекулярную массу, но обладают отличительными свойствами.
Методы изображения строения молекул
Для отображения порядка соединения атомов Бутлеров разработал структурную формулу. Связь между мельчайшими частицами изображается в виде черточек. Их количество определяет число общих электронных пар. Валентность углерода равна 4, поэтому он всегда образует 4 связи. С помощью этой формулы было подтверждено существование вторичных и третичных спиртов.
По числу углеродных атомов частицы подразделяются на следующие виды:
- первичные: соседствуют с 1 атомом углерода;
- вторичные: имеют 2 соседних углеродных атома;
- третичные: соседствуют с 3 атомами углерода;
- четвертичные: имеют 4 соседних углеродных атома.
Отображение молекул органических веществ осуществляется при помощи брутто-формул. Они представляют собой запись количественного и качественного состава вещества в сокращенном виде. Всем классам органических соединений соответствует общая формула гомологического ряда. Она показывает количественный состав гомологов, отличающихся на 1 группу CH2. Примеры гомологов: этан (С2H6) и пропан (C3H8).
Синтез веществ
На основе бутлеровской теории производится синтез органических соединений. Ученый доказал, что при помощи контролируемых реакций возможно создать новые вещества. Спустя несколько лет после публикации учения Бутлерова было проведено множество экспериментов. В их результате получилось синтезировать изобутилен, изомеры пентана и соединения, относящие к спиртам.
Современные технологии позволяют производить синтез веществ из нескольких сложных элементов, что позволяет улучшить их химические свойства. Для синтезирования применяются металлоорганические соединения, богатые электронами. Они используются при массовом производстве насыщенных углеводородов и сверхтонких волокон.
Систематизация знаний о химии
Бутлеровская теория позволила систематизировать знания о веществах и объяснить основные химические явления с точки зрения математической логики. Ученый первым в истории доказал наличие упорядоченной структуры атомов. При помощи использования элементов геометрии и комбинаторики создатель теории химического строения смог разработать классификацию атомных соединений, что позволило ученым выявлять свойства и характер сложных веществ без проведения комплексных исследований.
Влияние на науку
Теория имеет огромное значение для развития химического моделирования и представления общенаучной картины мира. Она позволила:
- классифицировать органические соединения по свойствам и строению атомов;
- использовать формулы для отражения строения молекул и химической связи между атомами сложных веществ;
- предсказывать свойства неоткрытых элементов и разрабатывать способы их синтеза в лабораторных условиях;
- изучить явление изомерии и выявить отличия в качественном и количественном составе органических соединений.
На основе бутлеровской теории была создана классификация углеводородов, являющихся объектом изучения органической химии. Она включает в себя 8 основных подклассов:
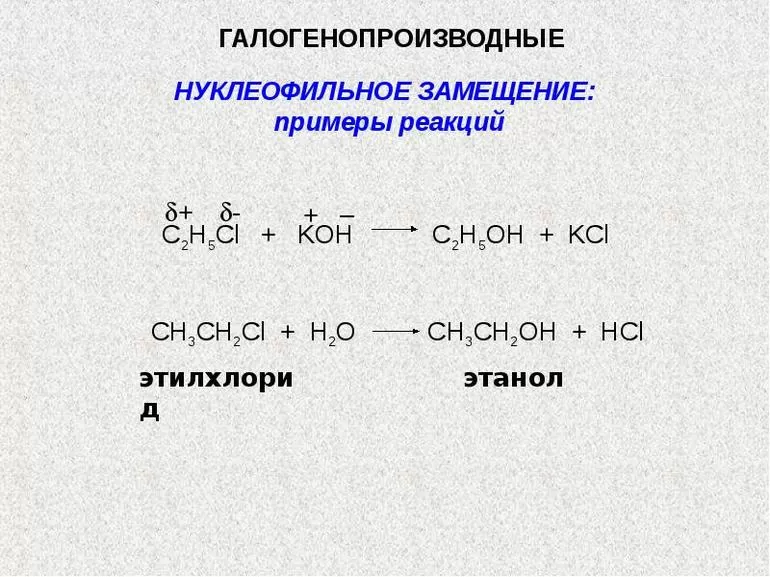
- Галогенопроизводные: образованы от галогенов (химических элементов, находящихся в 17 группе периодической системы Д. И. Менделеева).
- Спирты: включают в себя несколько гидроксильных групп.
- Простые и сложные эфиры: имеют 2 углеводородных радикала. Являются производными карбоновых кислот.
- Карбонильные соединения (альдегиды и кетоны): их молекулы содержат карбонильную группу.
- Карбоновые кислоты: в молекулах содержатся карбоксильные группы.
- Амины: являются производными аммиака. В их молекулах атомы водорода замещаются углеводородными радикалами.
- Нитросоединения: в молекулах содержится несколько нитрогрупп, состоящих из азота и кислорода.
- Сульфокислоты: содержат в себе сульфогруппы, состоящие из серы, кислорода и водорода. Выделяются ароматические, гетероциклические сульфокислоты и алкансульфокислоты.
Основные наименования представителей этих групп содержатся в общей номенклатуре ИЮПАК, созданной Международным союзом теоретической и прикладной химии. Переход между классами осуществляется посредством ряда последовательных химических реакций, при этом углеродная основа соединений не изменяется.
Это явление называется органическим синтезом и используется во время производства лекарственных препаратов, косметических средств, растительных удобрений, бытовых товаров и топливных жидкостей для транспортных средств.
Источник
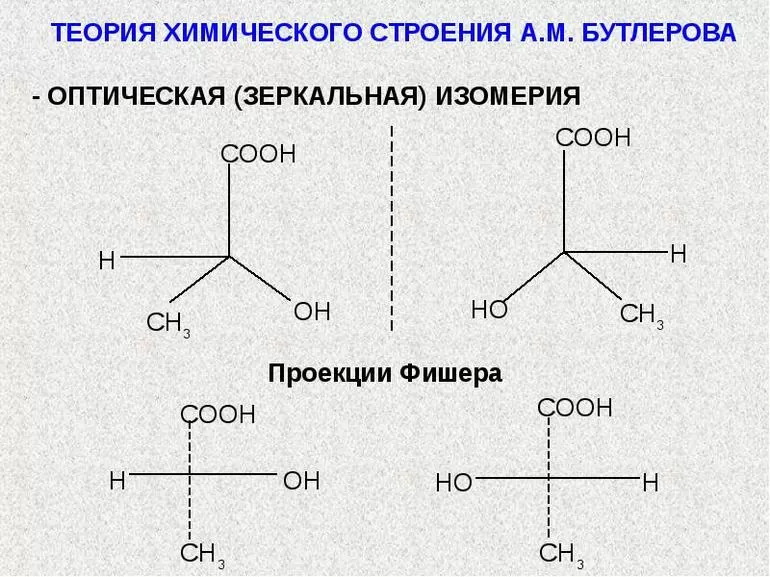
Понятие химического строения, данное А. М. Бутлеровым, включает порядок химической связи атомов в молекуле и в своем первоначальном виде не содержит каких-либо положений о размещении атомов в пространстве. Однако А. М. Бутлеров ясно сознавал неизбежность возникновения новой области органической химии — стереохимии. Совершенно справедливо полагая, что первоочередная задача заключается в установлении порядка химической связи атомов в молекулах и выяснении зависимости химических свойств вещества от его химического строения, А. М. Бутлеров не считал возможным в то время специально заниматься вопросами расположения атомов в пространстве. Однако он выступал против всяческих попыток считать это пространственное расположение принципиально непознаваемым. «Если же атомы действительно существуют, то я не вижу, почему, как думает Кольбе, должны быть тщетными все попытки определить пространственное расположение последних, почему будущее не должно научить нас производить подобное определение?»,— писал А. М. Бутлеров в 1863 г.
В 1874 г. французский ученый Ле-Бель (1847—1930) и голландский ученый Вант-Гофф (1852—1911), независимо друг от друга, высказали предположение, что четыре атома или радикала, связанные с углеродным атомом, расположены не в одной плоскости, а в пространстве по углам тетраэдра, в центре которого находится углеродный атом. Пространствен ное расположение четырех атомов вокруг атома углерода изображено на рис. 1. Если заменить любой из четырех атомов а каким-либо иным атомом b, то получатся пространственные фигуры, которые после вращения в пространстве при наложении совпадают друг с другом, а следовательно, изображаемые этими фигурами молекулы тождественны между собой. То же будет происходить при замещении любого второго атома а атомом с. Но при замещении одного из двух оставшихся незамещенными атомов а на атом d возможны два различных пространственных расположения, изображаемых в перспективе фигурами рис. 2 и 3.
Эти фигуры ни при каком вращении в пространстве не могут совпасть друг с другом. Если из четырех точек а, b, с, d две любые точки совпадают, то остальные две точки окажутся расположенными в противоположных углах тетраэдра. Молекулы, построенные в пространстве аналогично изображенным схемам, следовательно, не тождественны, а различны; поэтому должны быть различны и составленные из этих молекул вещества.
Таким образом, стереохимическая теория приводит к выводу, что если молекула асимметрична (не имеет элементов симметрии), то при одинаковом порядке связи атомов в молекуле появляется изомерия, зависящая от различия в пространственном расположении атомов, так называемая пространственная изомерия, или стереоизомерия.
Внимательное рассмотрение моделей, изображенных на рис. 2 и 3, показывает, что в указанном случае молекулы обоего рода чрезвычайно сходны между собой и отличаются друг от друга только как несимметричный предмет (не имеющий плоскости симметрии) отличается от своего зеркального изображения.
Так, зеркальное изображение левой перчатки не может совпасть с самой левой перчаткой, но может совпасть с правой перчаткой. Формы правой и левой рук не могут совпасть в пространстве, хотя они относятся друг к другу, как предмет к зеркальному изображению. Так же отличаются между собой винты с правой и левой нарезкой.
При наличии в молекуле углеродного атома, соединенного с четырьмя различными атомами или группами, возможно существование двух изомерных форм молекул, относящихся друг к другу, как несимметричный предмет к своему зеркальному изображению. Поэтому такой атом называется асимметрическим атомом углерода.
Вытекающая из стереохимической гипотезы, как следствие, необходимость существования особой изомерии при наличии в молекуле асимметрического атома углерода прекрасно согласуется с фактами. Такая изомерия еще до возникновения стерео-химической гипотезы была открыта знаменитым французским ученым Пастером (1848) при изучении им винной кислоты, молекула которой содержит два асимметрических атома углерода. После создания стереохимической гипотезы этот вид изомерии получил естественное объяснение. В дальнейшем было изучено огромное число примеров пространственной изомерии.
Две изомерные формы, молекулы которых относятся друг к другу, как предмет к зеркальному изображению, почти по всем химическим и физическим свойствам не отличаются друг от друга. Их плотность, температуры плавления и кипения, теплопроводность, электропроводность, показатель преломления и пр. совершенно одинаковы. Однако такие изомерные формы отличаются друг от друга двумя свойствами.
Первое свойство — способность этих веществ кристаллизоваться в так называемых энантиоморфных формах, т. е. в асимметрических формах, относящихся друг к другу (так же, как и сами стереоизомерные молекулы), как предмет к зеркальному изображению (рис. 4). Плоскость а находится у одного кристалла справа, а у другого слева, и их нельзя совместить никаким вращением (это же справедливо и относительно плоскости b).
Вторым важным свойством таких изомеров является их способность в жидком, газообразном состоянии и в растворах вращать плоскость поляризации света. Угол вращения плоскости поляризации для обоих изомеров одинаков, но направление вращения противоположное. Если один изомер вращает плоскость поляризации вправо, то второй вращает ее на такой же угол влево (при равной толщине слоя и одинаковой концентрации). Изомеры этого рода поэтому называются оптическими изомерами или оптическими антиподами, а сама изомерия носит название оптической изомерии.
Если смешать в жидком состоянии или в растворе равные количества обоих антиподов, то получится смесь, не вращающая вовсе плоскости поляризации, или оптически недеятельная (так как насколько одна из активных форм вращает плоскость поляризации вправо, настолько другая — влево). При кристаллизации этой смеси каждое вещество, согласно общему правилу, должно было бы кристаллизоваться отдельно, в присущей ему кристаллической форме. Однако последнее явление наблюдается сравнительно редко. В этих редких случаях при исследовании отдельных кристаллов обнаруживается присутствие правых и левых энантиоморфных форм, и так как большая часть их физических свойств тождественна, то и смесь кристаллов обладает рядом общих для обеих форм физических свойств, как, например, одинаковой плотностью, растворимостью и др. В большинстве же случаев активные формы обладают способностью вступать друг с другом в определенное молекулярное химическое соединение, содержащее оба антипода в отношении молекула на молекулу. Эти соединения антиподов, напоминающие своей непрочностью кристаллизационные соединения, носят название рацемических соединений. Как всякое молекулярное соединение, рацемическое соединение отличается всеми физическими свойствами от составляющих его веществ. Прежде всего, оно кристаллизуется в формах, отличных от форм активных сте-реоизомеров. Температура плавления, плотность и прочие подобные физические свойства рацемического соединения совершенно отличны от соответствующих свойств правого и левого изомеров.
Таким образом, при наличии в молекуле асимметрического атома углерода, кроме структурной изомерии, возможна еще и пространственная изомерия, или стереоизомерия. При наличии в молекуле лишь одного асимметрического атома углерода возможно существование двух стереоизомеров, являющихся оптическими антиподами. В случае присутствия двух или более асимметрических атомов углерода число стереоизомеров возрастает (при наличии п асимметрических атомов углерода в общем случае число оптически деятельных стереоизомеров равняется 2n). Если молекула по своему строению обладает отдельными элементами симметрии, то число стереоизомеров уменьшается, причем появляются стереоизомеры, действительно оптически недеятельные, т. е. не состоящие из молекул оптических антиподов.
Оптическая изомерия представляет собой только одну из разновидностей пространственной изомерии. Существуют некоторые разновидности пространственной изомерии, не связанные с наличием несовместимого зеркального расположения атомов в молекуле. Это, например, так называемая геометрическая, или цис-транс-изомерия, непредельных и циклических органических соединений, которая обусловлена различным расположением заместителей у углеродных атомов относительно двойной связи или плоскости кольца, например:
Легко видеть, что такого рода стереоизомеры не относятся друг к другу, как предмет к своему зеркальному изображению. Расстояния между заместителями у транс-изомеров всегда иные, чем у цис-изомеров. Отличия в строении цис- и транс-изомеров больше, чем в строении оптических антиподов. Вследствие этого цис-и транс-изомеры существенно различаются как по физическим, так и по химическим свойствам.
У циклических соединений геометрическая и оптическая изомерия зачастую встречается одновременно, например:
Пространственная изомерия, как оптическая, так и геометрическая, встречается не только у соединений углерода, но и у соединений некоторых других . многовалентных элементов (азот, кремний, олово, сера, селен, теллур и др.).
Таким образом, из стереохимической теории вытекает, что не всегда достаточно установить последовательность связи атомов в молекуле, чтобы признать строение вещества полностью выясненным. При некоторых особенностях строения молекулы, кроме последовательности связи атомов, необходимо установить и их пространственное расположение, т. е. конфигурацию молекулы.
Способы установления конфигурации молекулы будут рассмотрены после более подробного ознакомления со свойствами некоторых классов органических веществ.
Согласно представлениям классической стереохимии, вокруг простых связей возможно вращение частей молекул. Следовательно, вотличие от дихлор-зтилена СНСl=СНСl, для которого возможны цис- и транс-изомеры
дихлорэтан СН2Сl—СН2Сl не должен иметь изомеров, обусловленных различным углом поворота групп СН2Cl вокруг углерод-углеродной связи. Действительно, обычными химическими методами не удается ни выделить, ни обнаружить изомеров такого типа, за исключением некоторых специальных случаев.
Однако подробное изучение физических свойств веществ (дипольные моменты, оптические свойства, термодинамические характеристики) показывает, что внутреннее вращение в молекулах вокруг простых связей обычно является не свободным, а заторможенным: повороты вокруг простых связей требуют определенной затраты энергии. Это обстоятельство и обусловливает возможность существования молекул в виде энергетически неравноценных форм, переходящих друг в друга только за счет свободного вращения иобычно называемых конформациями.
На рис. 5 приведено изменение потенциальной энергии внутреннего вращения в молекуле дихлорэтана. Можно видеть, что по мере поворота групп СН2Сl вокруг оси углерод-углеродной связи энергетическая кривая проходит через минимумы и максимумы. Минимумы энергии отвечают термодинамически наиболее устойчивым конформациям (поворотным изомерам).
Таким образом, дихлорэтан представляет собой динамическую смесь трех конформаций: наиболее устойчивой заторможенной, или транс-конформации (φ = 0° и 360°), и двух так называемых скошенных конформаций (φ = 120° и 240°), которые обладают одинаковой энергией:
При обычных температурах преобладает более устойчивая заторможенная конформация. Она может превращаться в менее устойчивые скошенные при затрате определенной энергии, например при нагревании вещества. Поэтому при повышении температуры содержание скошенных конформаций возрастает (о чем, например, свидетельствует возрастание дипольного момента дихлорэтана с повышением температуры).
При достаточно низких температурах молекулы, обладающие различной конформацией, теряют возможность превращаться друг в друга. Известны случай настолько заторможенного вращения вокруг простой связи С—С, что по воротные изомеры удается изолировать в индивидуальном состоянии и при обыч ных условиях. Так обстоит дело, например, в случае изомерии производных бифенила.
Применительно к изучению органических веществ стереохи-мическая теория дала чрезвычайно плодотворные результаты. В громадном большинстве случаев, особенно поскольку это касается стереоизомерии соединений, содержащих асимметрические атомы углерода, предсказания, сделанные на основе этой теории, блестяще оправдались и дали ряд новых надежных методов исследования органических веществ.
При данном определенном составе молекул взаимное расположение атомов в пространстве является вторым по важности фактором (первый — последовательность химической связи атомов), определяющим химические и физические свойства вещества. Поэтому можно расширить бутлеровское понятие химического строения, включив внего также пространственное строение молекулы. В этом случае сохраняет силу положение, согласно которому свойства вещества определяются его химическим строением.
Источник
